题目内容
17.下列化学反应的离子方程式不正确的是( )| A. | 小苏打溶液与乙酸溶液混合 HCO${\;}_{3}^{-}$+CH3COOH═CH3COO-+H2O+CO2↑ | |
| B. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| C. | Fe2O3溶于HI溶液中 Fe2O3+6H++2I-═2Fe2++3H2O+I2 | |
| D. | 过量CO2通入NaAlO2溶液中:2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO2${\;}_{3}^{-}$ |
分析 A.反应生成醋酸钠、水、二氧化碳;
B.反应生成氯化钠、次氯酸钠和水;
C.发生氧化还原反应生成碘化亚铁、碘、水;
D.反应生成氢氧化铝和碳酸氢钠.
解答 解:A.小苏打溶液与乙酸溶液混合的离子反应为HCO3-+CH3COOH═CH3COO-+H2O+CO2↑,故A正确;
B.冷的氢氧化钠溶液中通入氯气的离子反应为Cl2+2OH-═ClO-+Cl-+H2O,故B正确;
C.Fe2O3溶于HI溶液中的离子反应为Fe2O3+6H++2I-═2Fe2++3H2O+I2,故C正确;
D.过量CO2通入NaAlO2溶液中的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列物质属于天然高分子的是( )
| A. | 聚氯乙烯 | B. | 蚕丝 | C. | 塑料 | D. | 合成橡胶 |
5.2SO2(g)+O2(g)?2SO3(g)△H<0 400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡
( )
( )
| A. | 甲和丙的K相同 | B. | 乙和丙的正反应速率相同 | ||
| C. | 乙中SO3的体积分数小于丙 | D. | 转化率:α甲(SO2)+α乙(SO3)<1 |
2.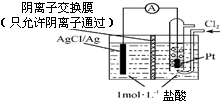 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法不正确的是( )
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法不正确的是( )
 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法不正确的是( )
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法不正确的是( )| A. | 充分放电后左侧溶液中的盐酸浓度基本不变 | |
| B. | 放电时,交换膜右侧溶液不会有大量白色沉淀生成 | |
| C. | 正极反应为Cl2+2e-+2Ag+═2AgCl | |
| D. | 当电路中转移0.01 mol e-时,经过交换膜的离子是0.01 mol |
6. 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
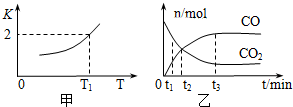
(1)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、p pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$(用分数表示),平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$(分数表示).
(2)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定如表.
起始时乙容器中的压强是甲容器的0.8倍.
(3)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出b kJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.
 氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.(1)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.
①该反应的逆反应是放热(填“吸热”或“放热”)反应.
②T℃、p pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是A.
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为$\frac{2}{3}$(用分数表示),平衡时混合气体的密度与起始时气体的密度之比为$\frac{25}{33}$(分数表示).
(2)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2?2NH3,有关数据及平衡状态特定如表.
| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
(3)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出b kJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 $\frac{6}{7}$倍.请写出该反应的热化学方程式4N2O(g)+2CO(g)═4N2(g)+2CO2(g)+O2(g)△H=-60bkJ•mol-1.