题目内容
【题目】在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
A. SO2、O2分别为0.4 mol/L、0.2 mol/L B. SO2为0.25 mol/L
C. SO2、SO3均为0.15 mol/L D. SO2为0.24 mol/L,SO3为0.14 mol/L
【答案】B
【解析】
A、SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度分别为0.4mol·L-1、0.2mol·L-1,因可逆反应,实际变化应小于该值,所以SO2小于0.4mol·L-1,O2小于0.2mol·L-1,故A错误;
B、若SO2为0.25mol·L-1,则O2为0.125mol·L-1,SO3为0.15mol·L-1,反应向左进行,为各物质共存状态,符合可逆反应的特点,故B正确;
C、反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,否则违背质量守恒定律,故C错误;
D、根据硫元素守恒可知,二氧化硫与三氧化硫的浓度之和应为0.4mol/L,故D错误。
综上所述,本题选B。

【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
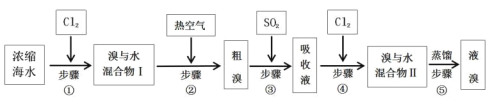
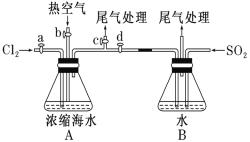
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
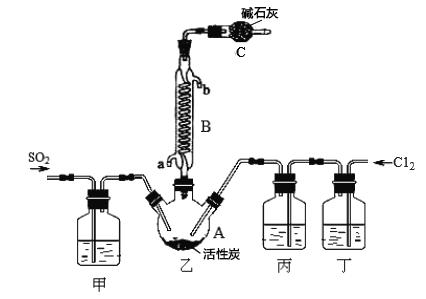
(1)从下表中选择相应的装置完成填空:
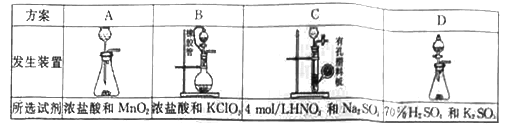
①制备SO2选________(填字母)。
②写出用所选装置制取Cl2的离子方程式_________________。
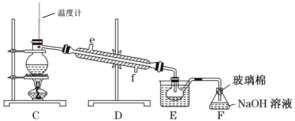
(2)合成SO2C12的装置图中仪器B的名称为_________________;丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)为提高本实验中的产率,在实验操作中还需要注意的事项有(只答—条即可)__________。
(6)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。