��Ŀ����
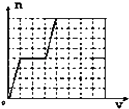
����Ŀ������Ӧ5IO3��+I��+6H+3I2+3H2O��Ƴ���ͼ��ʾ��ԭ��أ���ʼʱ����ձ��м�������Ũ���ᣬ������ָ�뷢��ƫת��һ��ʱ�������ָ��ص��㣬������ձ��е��뼸��ŨNaOH��Һ��������ָ���ٴη���ƫת�������жϲ���ȷ���ǣ� �� 
A.��ʼ��������Ũ����ʱ������ʯī�缫�Ϸ���������Ӧ
B.��ʼ��������Ũ����ʱ��ͬʱ�ڼס����ձ��ж����������Һ��ֻ�����ձ�����Һ����
C.�����ƶ���Ϊ��ʱ����Ӧ�ﵽ��ѧƽ��״̬
D.���ε�����ָ��ƫת�����෴
���𰸡�B
���������⣺A����ʼ��������Ũ����ʱ������I��ʧ��������I2 �� ������ʯī�缫�Ϸ���������Ӧ����A��ȷ�� B������I��ʧ���ӷ���������Ӧ����I2 �� ����IO3���õ��ӷ�����ԭ��Ӧ����I2 �� ����������Һ�������ձ��о�����ɫ����B����
C���÷�ӦΪ���淴Ӧ������Ӧ�ﵽƽ��״̬ʱ�������ʵ�Ũ�Ȳ��ٸı䣬��û�е���ͨ�������ƣ����Ե����ƶ���Ϊ�㣻��C��ȷ��
D����ʼ��������Ũ����ʱ������I��ʧ��������I2 �� ����Ϊ����������IO3���õ�������I2 �� ���Ϊ������������ձ��е��뼸��ŨNaOH��Һ�����I2��ʧ��������IO3�� �� ��Ϊ��������Ϊ���������ε缫���������෴�������ε�����ָ��ƫת�����෴����D��ȷ��
��ѡB��