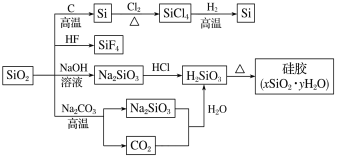
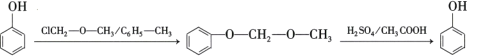
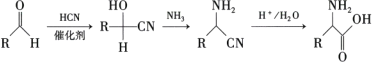
题目内容
【题目】钠、镁、铝、铁是四种重要的金属。请回答:
(1)钠的熔点比铁的熔点__________(填“高”或“低”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为__________________。
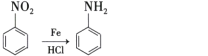
(3)若D为上述四种金属单质中的一种;A、B为气体单质,其中A为黄绿色气体,B为无色气体;C为化合物,其水溶液显酸性;F的水溶液遇到KSCN溶液会呈现血红色。它们之间有下列转化关系:
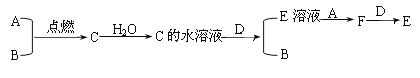
①将紫色石蕊试液滴入A的饱和溶液中,实验现象为___________________。
②写出C的水溶液与D反应的离子方程式:________________________。
③在F的水溶液加入D,反应的离子方程式是:______________________。
【答案】低 2Na+2H2O=2Na++2OH-+H2↑ 溶液先变红后褪色 Fe+2H+=Fe2++ H2↑ Fe+2Fe3+=3Fe2+
【解析】
(3)A、B为气体单质,其中A为黄绿色气体,B为无色气体;C为化合物,其水溶液显酸性,则A为Cl2,B为H2,C为HCl;D为金属单质,与盐酸反应产生H2和E溶液,E与Cl2反应生成F,F的水溶液遇到KSCN溶液会呈现血红色,说明F中含有Fe3+,F为FeCl3,E为FeCl2,D与F反应,则D为变价金属Fe,然后利用物质的性质结合题目要求来解答。
(1)Na是碱金属,熔点很低,只有97.81℃,稍微受热就熔化变为液态,而Fe的熔点是1535℃,可见,钠的熔点比铁的熔点低;
(2)钠与水反应产生氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
(3)根据上述分析可知:A为Cl2,B为H2,C为HCl;D为Fe,E为FeCl2,F为FeCl3。
①由于氯气溶于水,和水反应生成盐酸和次氯酸,盐酸具有酸性,可以使紫色石蕊试液变红色,而次氯酸具有强氧化性,会使变红的石蕊试液又褪色,因此将紫色石蕊试液滴入A的饱和溶液中,看到的现象是溶液先变红后褪色;
②C的水溶液是盐酸,具有酸性,与金属Fe发生置换反应,产生FeCl2和H2,反应的离子方程式为:Fe+2H+=Fe2++ H2↑;
③FeCl3具有强的氧化性,与Fe反应产生FeCl2,所以在含有FeCl3的水溶液加入Fe,反应的离子方程式为:Fe+2Fe3+=3Fe2+。