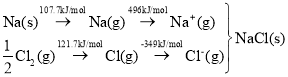题目内容
【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,易溶于乙醇和丙醇等有机溶剂。
Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓)![]() CH3Cl+H2O。
CH3Cl+H2O。
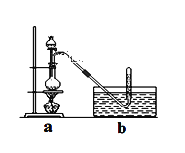
具体步骤如下:①干燥ZnCl2晶体;②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是________________;
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是__________;
Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化,现有四只洗气瓶分别盛有以下试剂:A.1.5%KMnO4(H+)溶液;B.蒸馏水;C.5%Na2SO3溶液;D.98%H2SO4。
(1)为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶____(填洗气瓶编号),如果观察到_________则证实上述资料的正确性。
(2)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):______;
(3)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛______的洗气瓶。
【答案】在干燥的HCl气流中加热 增大盐酸的量以提高甲醇的转化率 BAC 紫色褪去 10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32-+Cl2+H2O=SO42-+2Cl-+2H+ 乙醇或丙醇
【解析】
Ⅰ.(1)因ZnCl2晶体直接加热时,因Zn2+水解,如果直接加热最终得到的是Zn(OH)2,因此要用浓盐酸或HCl气体抑制其水解的同时加热;
(2)当有两种反应物参加反应时,可通过提高一种反应物的量提高另一种反应物的转化率;
Ⅱ.(1)如果CH3Cl能被酸性高锰酸钾氧化,则酸性高锰酸钾溶液本身会褪色,同时可能会生成CO2和Cl2,因此要注意尾气的处理;
(2)CH3Cl经过酸性高锰酸钾的洗气瓶会被氧化成CO2和Cl2,生成的Cl2可选择Na2SO3溶液,利用氯气的氧化性,将Na2SO3氧化为Na2SO4;
(3)因CH3Cl易溶于乙醇和丙醇等有机溶剂,因此的尾气可选择有机溶剂吸收。
Ⅰ.(1)ZnCl2为强酸弱碱盐,在加热ZnCl2晶体时可选择通HCl气体抑制其水解;
(2)为了提高甲醇的利用率,可以适当增加盐酸的量;
Ⅱ.(1)如果CH3Cl能被强氧化剂酸性高锰酸钾氧化,可选择先通过盛有水的洗气瓶除去可能混合有的HCl和甲醇,再通过盛有的酸性高锰酸钾洗气瓶,溶液的紫色会褐去,最后通过盛Na2SO3的洗气瓶吸收生成的氯气防污染;
(2)酸性高锰酸钾氧化CH3Cl会生成CO2和Cl2,同时自身被还原成Mn2+,发生反应的离子方程式为10CH3Cl+14MnO4-+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O,生成的氯气经过Na2SO3的洗气瓶会氧化Na2SO3为Na2SO4,发生反应的离子方程式为SO32-+Cl2+H2O=SO42-+2Cl-+H+;
(3)CH3Cl易溶于乙醇和丙醇等有机溶剂,可选择酒精吸收CH3Cl的尾气。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】观察下表模型并结合有关信息,判断下列说法中不正确的是( )
B12结构单元 | SF6分子 | S8分子 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
【题目】有反应:![]() ,
,![]() 时该反应的平衡常数
时该反应的平衡常数![]() 。
。![]() 时,将一定量的
时,将一定量的![]() 和
和![]() 充入容积为某10L密闭容器发生上述反应,5min时达平衡,
充入容积为某10L密闭容器发生上述反应,5min时达平衡,![]() 只改变了一个条件,10min时再次达平衡,各物质物质的量
只改变了一个条件,10min时再次达平衡,各物质物质的量![]() 变化如下:
变化如下:
0min | 5min | 10min | |
CO |
|
| |
|
|
| |
| 0 |
| |
| 0 |
|
下列说法正确的是![]()
A.![]() 时用
时用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.![]() 改变的条件是再加入了
改变的条件是再加入了![]()
![]()
C.![]() 时,若向容器中充入
时,若向容器中充入![]()
![]() 、
、![]()
![]() 、
、![]() 、
、![]() ,达平衡时,
,达平衡时,![]() 的浓度为
的浓度为![]()
D.![]() 时,若向容器中充入
时,若向容器中充入![]()
![]() 、
、![]()
![]() 、
、![]() 、
、![]()
![]() 正
正![]() 逆
逆![]()
【题目】一定温度下,在4个体积均为 1.0 L的恒容密闭容器中反应2SO2(g)+O2 (g)![]() 2SO3(g) 达到平衡。
2SO3(g) 达到平衡。
下列说法正确的是
容器 | 温度/K | 物质的起始浓度/moI/L | 物质的平衡浓度moI/L | O2或SO3平衡转化率 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
Ⅰ | 723 | 0.2 | 0.2 | 0 | 0.04 | α1 |
Ⅱ | 723 | 0 | 0.1 | 0.2 | α2 | |
Ⅲ | 723 | 0.4 | 0.4 | 0 | α3 | |
IV | 823 | 0 | 0.1 | 0.2 | α4 | |
A. 达到平衡时, α1+α2=1
B. 达到平衡时,容器中的压强:PⅠ>PIV
C. 达到平衡时,逆反应速率容器IV中比容器Ⅰ中的大
D. 达平衡后,再向容器Ⅰ中充入0.16 mol SO2、0.04 mol SO3,则此时反应向逆反应方向进行
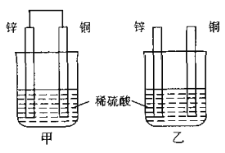
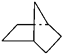
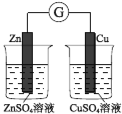
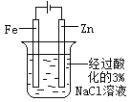
【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
片刻后在 Fe 电极附近滴入铁氰化钾溶液 |
|
验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证 Fe 电极被保护 | 验证AgCl 溶解度大于Ag2S |
A.AB.BC.CD.D