题目内容
【题目】甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜(2NH3+3CuO![]() N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
N2+3Cu+3H2O)。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
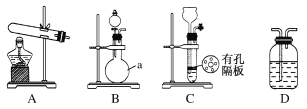
甲小组测得,反应前氧化铜的质量m1 g、氧化铜反应后剩余固体的质量m2 g、生成氮气在标准状况下的体积V1 L。乙小组测得,洗气前装置D的质量m3 g、洗气后装置D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:________。
(2)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、 硫酸、硫酸铵 | 反应的化学方程式为①____________________ |
乙小组 | ②______ | 浓氨水、氢氧化钠 | 氢氧化钠溶于氨水后放热,增加氢氧根离子浓度,加快氨气逸出 |
(3)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为________。
(4)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是__________________________________。
【答案】(1)圆底烧瓶
(2)①(NH4)2SO4+Ca(OH)2![]() 2NH3↑+2H2O+CaSO4
2NH3↑+2H2O+CaSO4
②B
(3)5V1∶7(m1m2)
(4)浓硫酸吸收了未反应的氨气,从而使计算的氢的含量偏高
【解析】(1)仪器a的名称为圆底烧瓶。
(2)①氢氧化钙与硫酸铵反应生成硫酸钙、氨气和水,反应的化学方程式为(NH4)2SO4+Ca(OH)2![]() 2NH3↑+2H2O+CaSO4;②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,氨气挥发放出气体,故选B装置。
2NH3↑+2H2O+CaSO4;②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,氨气挥发放出气体,故选B装置。
(3)反应前氧化铜的质量为m1 g、氧化铜反应后转化成的铜的质量为m2 g,则氧化铜中氧元素的质量为(m1m2)g,生成的水中氧元素的质量等于参加反应氧化铜中氧元素的质量,则生成的水中氧原子的个数为[(m1m2)/16]NA;水中氢原子个数是氧原子个数的两倍,因此氢原子个数为[(m1m2)/16]×2NA,生成的氮气在标准状况下的体积为V1 L,则氮气中氮原子的个数为(2V1/22.4)NA;因此氮、氢原子个数比为(2V1/22.4)NA∶{[(m1m2)/16]×2NA}=5V1∶7(m1m2)。
(4)乙小组用所测数据计算出氨分子中氮、氢的原子个数比小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案