题目内容
【题目】【2017河南模拟】某课题组设计实验探究SO2的性质.
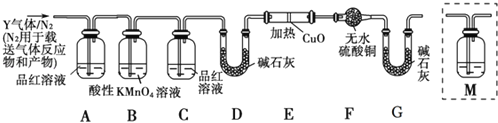
实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀.
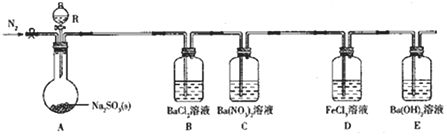
(1)仪器R的名称是 ;
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式: ;
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应.“通入一段时间的N2”的目的是 ;
(4)探究装置C中通入SO2的量与产物的关系.
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3﹣+3SO2+2H2O═BaSO4↓+2SO42﹣+2NO+4H+.
猜想2:通入少量的SO2,则发生反应的离子方程式为 ;
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中, |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是 (填字母).
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH 7(填“>”“<”或“=”)。
【答案】(1)分液漏斗 (2)Na2SO3+H2SO4═Na2SO4+SO2↑+H2O (3)排尽装置内空气,避免O2干扰实验
(4)①3Ba2++2NO3﹣+3SO2+2H2O=BaSO4↓+2NO+4H+ ②加入铜粉(或BaCl2溶液);若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 (5) c (6)<
【解析】分析装置中实验现象可知:B中无沉淀生成生成气体中午三氧化硫,C中有白色沉淀证明生成的二氧化硫通入硝酸钡溶液中发生氧化还原反应,二氧化硫被氧化为硫酸,生成硫酸钡白色沉淀;D中溶液颜色变浅是二氧化硫和氯化铁反应生成氯化亚铁和硫酸,E中产生白色沉淀是二氧化硫和氢氧化钡反应生成亚硫酸钡白色沉淀,装置A中亚硫酸钠和浓硫酸反应生成二氧化硫气体,装置B是检验是否生成三氧化硫,装置C、D是验证二氧化硫的还原性,装置E是氢氧化钡吸收二氧化硫气体;
(1)仪器R是添加溶液的分液漏斗;
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,A中反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应.“通入一段时间的N2”的目的是:排尽装置内空气,避免O2干扰实验;
(4)①猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3﹣+3SO2+2H2O═BaSO4↓+2SO42﹣+2NO+4H+.
猜想2:通入少量的SO2,二氧化硫钡氧化生成的硫酸根离子全部沉淀,溶液中存在稀硝酸,则发生反应的离子方程式为:3Ba2++2NO3﹣+3SO2+2H2O=BaSO4↓+2NO+4H+;
②设计实验证明猜想1和猜想2哪个合理,取少量C中反应后溶液于试管中加入铜粉(或BaCl2溶液);若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确;
(5)检验装置D反应后溶液中是否有Fe2+的最佳试剂是c.K3[Fe(CN)6]溶液,遇到亚铁离子生成蓝色沉淀,故答案为c;
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),说明滴入盐酸和亚硫酸钠反应生成亚硫酸氢钠,亚硫酸氢钠溶液中电离大于亚硫酸氢根离子的水解,溶液显酸性,所得溶液的pH<7。