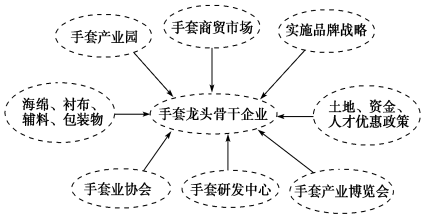
题目内容
【题目】能说明溶液呈中性的可靠依据是
A.pH=7 B.c(H+)=c(OH) C.紫色石蕊试液不变色 D.强酸强碱盐的溶液
【答案】B
【解析】A.pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是1012,pH=6时溶液呈中性,当pH=7时溶液呈碱性,故A错误; B.c(H+)=c(OH)溶液一定呈中性,故B正确;C. 紫色石蕊试液不变色的溶液不一定显中性,可能显弱酸性或弱碱性,故C错误;D. 强酸强碱盐的溶液不一定呈中性,如硫酸氢钠溶液,显酸性,故D错误;故选B。

【题目】【2017河南模拟】某课题组设计实验探究SO2的性质.
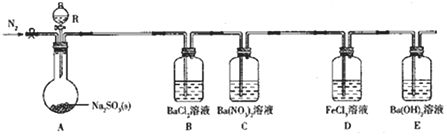
实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是 ;
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式: ;
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应.“通入一段时间的N2”的目的是 ;
(4)探究装置C中通入SO2的量与产物的关系.
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3﹣+3SO2+2H2O═BaSO4↓+2SO42﹣+2NO+4H+.
猜想2:通入少量的SO2,则发生反应的离子方程式为 ;
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中, |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是 (填字母).
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH 7(填“>”“<”或“=”)。
【题目】【2017惠州三模】如图A、B、C、D、E五组仪器(图中a、b、c表示止水夹)可以根据需要组装成不同实验装置.某兴趣小组的同学利用这些实验仪器进行实验,请对其方案进行完善或评价.
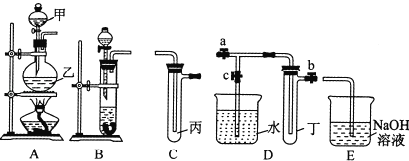
(1)将B、C、E相连,用浓硫酸和浓盐酸可制取氯化氢,装在分液漏斗中的试剂是 ,该实验尾气吸收装置设计有何不妥? ;改正后将B、D、E装置相连,用D装置中的丁试管收集满氯化氢气体,使烧杯中的水进人试管丁的操作是 ;
(2)将A、C、E相连,并在丙中加入适量水,即可制得氯水,将所得氯水分为两份,进行ⅠⅡ两个实验,实验操作、现象、结论如下表所示:
序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯水与水反应的产物有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯水与水反应的产物有具有酸性 |
请你评价:实验I推出的相应的结论是否合理? .若不合理,请说明理由,〔若合理则无需填写) .实验Ⅱ推出的结论是否合理? .若不合理,请说明理由,(若合理则无需填写) ;
(3)研究表明,用ClO2气体对自来水消毒效果比用Cl2更好.市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4.两种成分在溶液中混合便产生ClO2,反应的化学方程式为
。