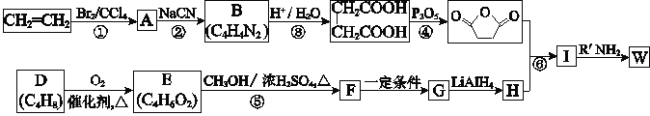
题目内容
【题目】碳、硅两元素广泛存在于自然界中,请回答下列问题:![]()
(1)基态14C原子的核外存在___________对自旋方向相反的电子,硅原子的电子排布式为___________________。
(2)晶体硅的结构与金刚石非常相似。晶体硅中硅原子的杂化方式为_______杂化;金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为_________________。
(3)科学研究结果表明,碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH。其反应原理如下:2CO2+2H2O![]() 2HCOOH+O2,则生成的HCOOH分子中δ键和π键的个数比是__________。
2HCOOH+O2,则生成的HCOOH分子中δ键和π键的个数比是__________。
(4)碳单质有多种形式,其中C60、石墨烯与金刚石的晶体结构如图所示:
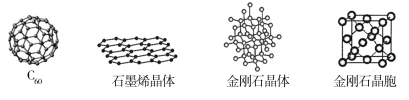
①C60、石墨烯与金刚石互为_____________。
②C60形成的晶体是分子晶体,C60分子中含有12个五边形和20个六边形,碳与碳之间既有单键又有双键,已知C60分子所含的双键数为30,则C60分子中有____个C—C键(多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数棱边数=2)。在石墨烯晶体中,每个C原子连接________个六元环;在金刚石晶体中,C原子所连接的最小环也为六元环,六元环中最多有________个C原子在同一平面。
③金刚石晶胞含有________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_____________a,列式表示碳原子在晶胞中的空间占有率为_____________(不要求计算结果)。
【答案】(1)2 1s22s22p63s23p2
(2)sp3 金刚石>金刚砂>晶体硅
(3)4∶1
(4)①同素异形体 ②60 3 4
③8 ![]()
![]()
【解析】(1)14C原子核外的电子排布式为1s22s22p2,两个s轨道上分别有2个自旋方向相反的配对电子,根据洪特规则,另两个p电子分居在两条轨道上;硅原子的电子排布式为1s22s22p63s23p2。
(2)晶体硅的每个原子均形成了四个Si—Si键,所以硅原子经过了sp3杂化;金刚石、晶体硅和金刚砂(碳化硅)三种晶体的结构相似,均为原子晶体,根据键长可以判断三种晶体的熔点由高到低的顺序为:金刚石>金刚砂>晶体硅。
(3)HCOOH分子中有1个δCH键、1个δOH键、2个δCO键和1个πCO键,即δ键和π键的个数比是4∶1。
(4)①C60、石墨烯与金刚石为不同结构的碳单质,三者互为同素异形体。
②已知C60的顶点数为60,面数为32,由欧拉定理计算键数(即棱边数):60+(12+20)2=90,已知该分子中含双键30个,C60分子中单键为:9030=60。在石墨烯晶体中,每个C原子连接3个六元环。由金刚石的晶体结构图可以看出,六元环中最多有4个C原子在同一平面。③由金刚石的晶胞结构可看出,碳原子位于晶胞的顶点、面心和体内,故含有的碳原子数目为![]() ×8+
×8+![]() ×6+4=8。根据硬球接触模型可知,在立方体的对角线上碳原子紧密接触,故8r=
×6+4=8。根据硬球接触模型可知,在立方体的对角线上碳原子紧密接触,故8r=![]() a,则r=
a,则r=![]() a,8个碳原子的体积为8×
a,8个碳原子的体积为8×![]() πr3=8×
πr3=8×![]() π×(
π×(![]() a)3=
a)3=![]() ,故原子利用率为
,故原子利用率为![]() 。
。