题目内容
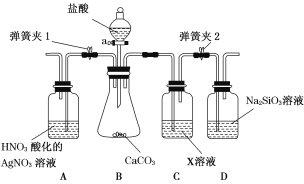
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,……,关闭活塞a。
请回答:
(1)B中反应的离子方程式为____________________________。
(2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性
C.氧化性 D.酸性
(3)C装置的作用是______________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________________,D中反应的化学方程式为_______________________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________________________(从原子结构角度加以解释)。
【答案】(12分)
(1)CaCO3+2H+===Ca2++CO2↑+H2O(2分)
(2)AD(2分)
(3)除HCl气体(1分) NaHCO3(1分)
(4)关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀(2分) Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3(2分)
(5)碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱(2分)
【解析】B中CaCO3与盐酸反应的离子方程式为CaCO3+2H+===Ca2++CO2↑+H2O,此反应表明盐酸具有酸性,A中看到的白色沉淀是AgCl沉淀,此现象表明盐酸具有挥发性。C装置是用NaHCO3溶液除去CO2中混有的HCl气体,以保证与Na2SiO3溶液反应生成白色胶状沉淀的是CO2,此反应的化学方程式为CO2+Na2SiO3+H2O===H2SiO3↓+Na2CO3,从而说明碳酸的酸性强于硅酸,进而证明碳的非金属性强于硅。

 名校课堂系列答案
名校课堂系列答案