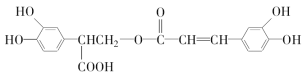
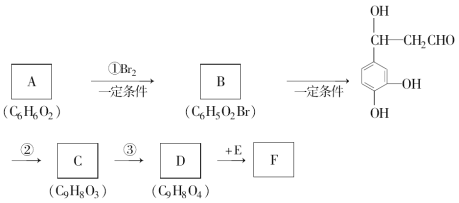
题目内容
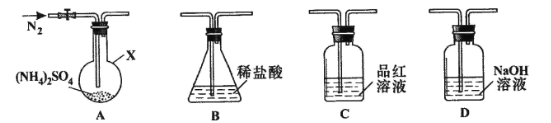
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过题9图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
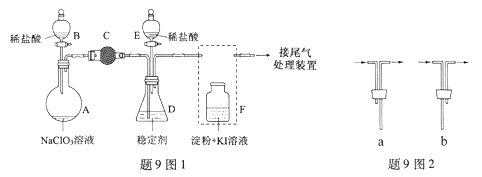
(1)仪器D的名称是 。安装F中导管时,应选用题9图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
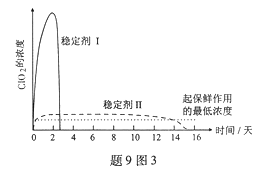
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如题9图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。
【答案】(15分)
(1)锥形瓶 b (2)慢 (3)吸收Cl2
(4)4H++5ClO2-=Cl-+4ClO2↑+2H2O 验证是否有ClO2 生成
(5)稳定剂Ⅱ,稳定剂Ⅱ可以缓慢释放ClO2 ,能较长时间维持保鲜所需的浓度
【解析】(1)根据仪器特征,仪器D的名称是锥形瓶;根据操作分析,F装置应是Cl2和KI反应,所以应该长管进气,短管出气,选b。
(2) 为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度要慢。
(3)F装置中能发生Cl2+2KI=2KCl+I2,碘遇淀粉变蓝,所以F中溶液的颜色若不变,则装置C的作用是吸收Cl2。
(4) 在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,再根据化合价升降相等和电荷守恒以及原子守恒配平,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成.
(5) 根据图3可知,稳定剂Ⅱ可以缓慢释放ClO2 ,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好。