题目内容
【题目】下列关于实验原理或操作的叙述中,不正确的是( )
A.从碘水中提取单质碘时,不能用无水乙醇代替CCl4
B.在苯甲酸的重结晶实验中结晶时的温度不是越低越好
C.纸上层析实验中,需将滤纸上的试样点浸入展开剂中
D.实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法
【答案】C
【解析】乙醇与水互溶,不能用作萃取剂,A项正确;在苯甲酸的重结晶实验中结晶时的温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯的目的,B项正确;乙酸和乙醇的沸点相差不大,通常情况下让乙酸与生石灰反应生成高沸点的乙酸盐,然后蒸馏得到乙醇,D项正确;在进行纸上层析实验时,不能将滤纸上的试样点浸入展开剂中,C项错误。

【题目】甲乙两同学分別对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置己略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4
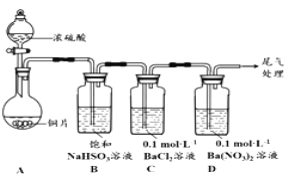
①A中反应的化学方程式是______________________。
②为探究SO2在D中所发生反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价硫元素的物质性质进行探究。
序号 | 实验操作 | 实验现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大重白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:____________________。
②由实验1、2、3对比,可以得到推论:____________________。
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取_______固体混合物,向其中加入10mL 2mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii实验1和4对比,乙获得推论:_____________________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加_________(填字母序号)
a. 2mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
b. 2mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
c. 2mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
d. 2mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀