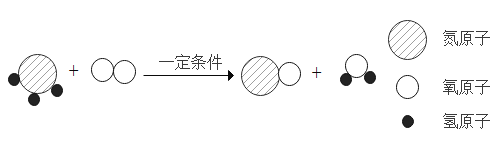
【题目】某化学兴趣小组使用如图所示装置,对某种铁铜合金的成分进行测量,先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:

空烧杯 | 加入 硫酸后 | 加入铁粉后 5分钟 | 加入铁粉后 12分钟 | 加入铁粉后 21分钟 | 加入铁粉后 40分钟 | 加入铁粉后 3小时 | |
读数(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
(1)完全反应后,生成氢气的总质量为_________。
(2)合金中铁元素的质量分数为多少? __________
【题目】四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
(阅读资料)
(1)25℃时,氢氧化物沉淀的pH范围如表
Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀的pH | 5.7 | 7.6 | 10.4 |
沉淀完全的pH | 8.0 | 9.6 | 12.4 |
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液。
(3)制备Fe3O4的实验流程如下:
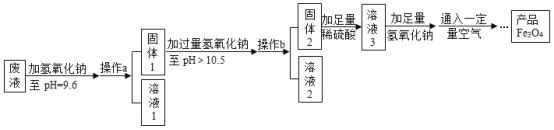
(回答问题)
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为______________(写一个即可)。
(2)操作a的名称为___。该操作需要的玻璃仪器有烧杯、玻璃棒、__________等。玻璃棒在此操作中的主要作用是___。
(3)溶液1所含溶质有_______(至少写两种);溶液3所含溶质的主要成分为___。