题目内容
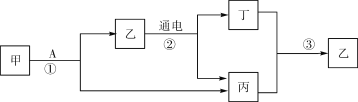
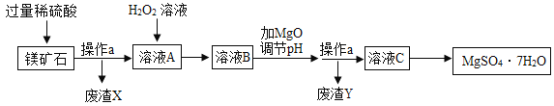
【题目】某化学兴趣小组使用如图所示装置,对某种铁铜合金的成分进行测量,先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:

空烧杯 | 加入 硫酸后 | 加入铁粉后 5分钟 | 加入铁粉后 12分钟 | 加入铁粉后 21分钟 | 加入铁粉后 40分钟 | 加入铁粉后 3小时 | |
读数(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
(1)完全反应后,生成氢气的总质量为_________。
(2)合金中铁元素的质量分数为多少? __________
【答案】0.4g 80%
【解析】
(1)反应生成氢气的质量为:169.7g+14.0g-183.3g=0.4g;故填:0.4g;
(2)解:设14.0g合金中铁的质量为x,
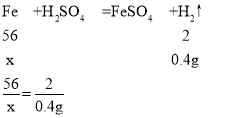
x=11.2g,
合金中铁的质量分数为:![]() ×100%=80%,
×100%=80%,
答:合金中铁的质量分数为80%。

练习册系列答案
相关题目