【题目】小明发现工业运输浓硫酸使用的是铁罐车,于是进行了探究。
(实验回顾)
把光洁的铁钉放到稀硫酸中,有气泡产生,请写出反应的化学方程式_____。
(提出问题)铁能与浓硫酸发生反应吗?为什么能用铁罐车来运输浓硫酸呢?
(查阅资料)
①常温下,铁与浓硫酸反应表面生成一层致密的氧化物薄膜,这层薄膜阻止了酸与内层金 属的进一步反应,化学上称之为钝化。
②SO2 可使品红溶液的红色褪去。
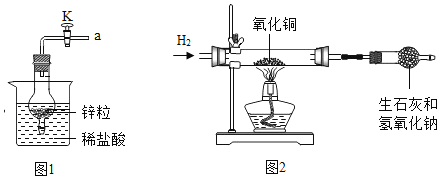
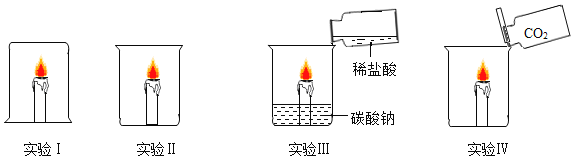
(实验探究)小明用相同的铁片和等量的浓硫酸按图 1 和图 2 所示的装置进行实验。
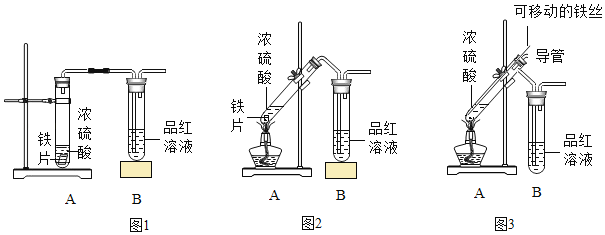
请帮助小明完成下表:
A 中硫酸浓度 | 实验条件 | B 中实验现象 | A 中生成的气体 | |
实验一 | 98% | 常温 | 品红溶液几乎不褪色 | 生成极少量的 SO2 |
实验二 | 98% | 加热 | 品红溶液褪色 | ______ |
(交流与讨论)
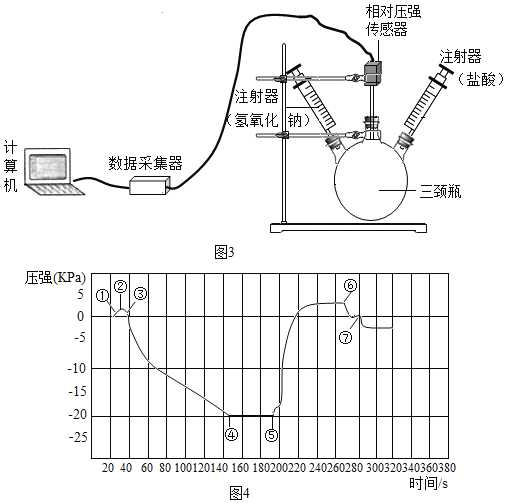
(1)小明将 A 装置进行了如图 3 所示的改进。 试分析用可移动的铁丝代替铁片的优点(至少写出两条)_____、_____。增加的导管有两个主要作用:一是在反应过程中,导 管伸入液面以下,起到液封作用,防止二氧化硫逸出;二是_____。
(2)在实验过程中,小明发现图 2 的装置有一处明显的不足,请对图 2 的装置提出改进意见_____。
(实验结论)铁与浓硫酸在加热条件下能持续反应,而常温下会因为钝化而使反应停止,
所以能用铁罐车运输冷的浓硫酸。
(实验反思)
(1)在加热的条件下铁与浓硫酸反应除生成二氧化硫外,还能生成硫酸铁和水。请写出铁与浓硫酸反应的化学方程式_____;
(2)经钝化处理后的铁丝在空气中不易生锈,原因是_____。
【题目】含氮化合物是重要的化工原料。
(1)氨气是由_____(填“分子”、“原子”或“离子”)构成的。
(2)氨气溶于水显碱性,是因为氨气与水反应生成了碱,请写出这种碱的化学式_____。
(3)NH4NO3 是一种重要的氮肥,请标出 NH4NO3中氮元素的化合价_____。已知NH4NO3和KCl固体混合物中氮元素的质量分数为28%,则混合物中KCl的质量分数 为_____。
(4)请完成鉴别氯化铵和硝酸铵两种溶液的实验报告。
实验步骤 | 实验现象 | 实验结论 |
______ | ______ | ______ |
【题目】实验室利用下图所示装置可以制取某些气体,请回答下列问题:
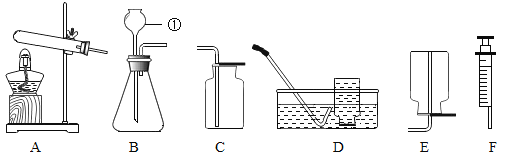
(1)写出编号①的仪器名称:_____。
(2)利用B装置可制取多种气体。装入药品前,可用注射器F检查装置B的气密性,步骤如下:
①向锥形瓶加水至_____以形成液封;
②将注射器F连接到装置B的导管口处;
③缓慢拉动注射器的活塞,观察到_____,表示装置B的气密性良好。
(3)实验室用装置B制取二氧化碳气体,则反应方程式是_____。
(4)实验室常用30%的过氧化氢溶液和二氧化锰制取氧气,用排水法收集氧气,测定集气瓶中氧气的含量,重复实验3次。实验数据如下:
实验1 | 实验2 | 实验3 | |
氧气的体积分数(%) | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 89.7 | ||
实验中获得氧气体积分数不能达到100%的主要原因可能是_____。
(5)氨气(NH3)是一种极易溶于水的气体,实验室常采用加热氯化铵(固体)和碱石灰(固体)的混合物来制取氨气,反应的化学方程式为_____,取一瓶氨气应选择的装置是_____。(填序号)