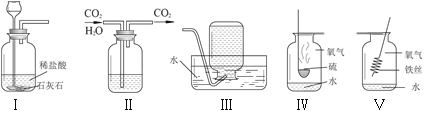
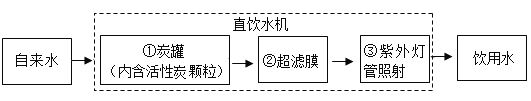
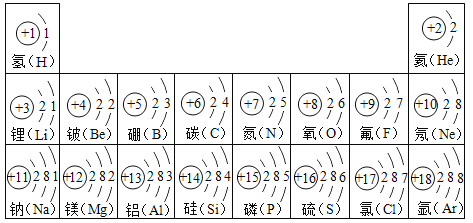
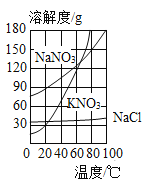
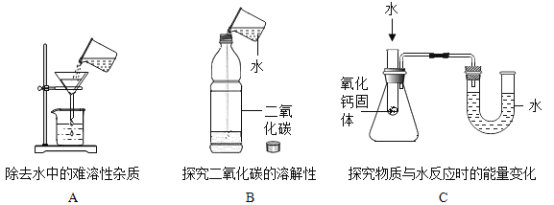
题目内容
【题目】碳酸锂作为锂的基础锂盐,广泛用于玻璃制造和陶瓷生成过程中的添加剂,也是制备锂电池的重要原料。碳酸锂在热水中的溶解度很小,工业上以锂辉石精矿(主要成分是Li2O,含有Al2O3、SiO2 等杂质)为原料制取碳酸锂,其“硫酸法”生产工艺流程如下图所示。请回答问题:
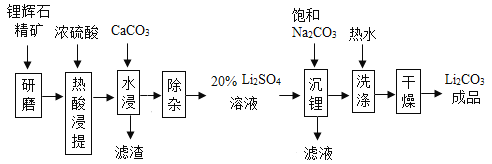
(1)锂辉石热酸浸提前要进行“研磨”,其目的是_____。
(2)“水浸”中加入CaCO3的作用之一是为了调节pH=5,让溶液中的Ai3+变成Al(OH)3沉淀出来,要确定溶液的pH为5,可以使用pH试纸来测定。其操作方法是_____。
(3)“沉锂 ”中要加入的Na2CO3溶液是饱和溶液,其作用是_____,反应化学方程式为_____。
(4)“洗涤”中使用热水,原因是_____。证明Li2CO3洗涤干净的方法是_____。(写操作,现象和结论)
【答案】为了增大矿物与酸的接触面积,加快热酸浸提的速率 将一小片pH试纸放在白瓷板上,用干燥玻璃棒蘸取溶液滴到pH试纸上,再与标准比色卡比对,读出pH 为了提高反应物的浓度,有利于Li2SO4转化为Li2CO3 Li2SO4+Na2CO3═Na2SO4+Li2CO3↓ 碳酸锂在热水中溶解度很小,避免了洗涤过程中碳酸锂的损耗 取少量洗涤后的溶液于试管中,滴入足量稀盐酸,充分反应后滴入氯化钡溶液,若无明显现象,则已洗涤干净
【解析】
(1)锂辉石热酸浸提前要进行“研磨”,其目的是为了增大矿物与酸的接触面积,加快热酸浸提的速率;
(2)正确保用pH试纸的方法是:将一小片pH试纸放在白瓷板上,用干燥玻璃棒蘸取溶液滴到pH试纸上,再与标准比色卡比对,读出pH;
(3)“沉锂”中加入的Na2CO3溶液是饱和溶液是为了提高反应物的浓度,有利于Li2SO4转化为Li2CO3;反应的化学方程式为:Li2SO4+Na2CO3═Na2SO4+Li2CO3↓;
(4)碳酸锂在热水中溶解度很小,避免了洗涤过程中碳酸锂的损耗;由于硫酸锂能与氯化钡反应生成了硫酸钡沉淀,和氯化锂,所以证明洗涤干净的方法是:取少量洗涤后的溶液于试管中,滴入足量稀盐酸,充分反应后滴入氯化钡溶液,若无明显现象,则已洗涤干净。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案