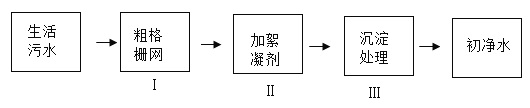
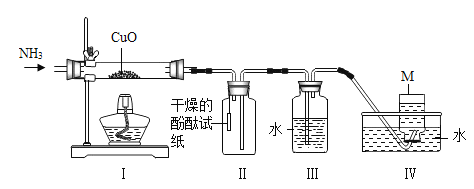
【题目】某同学利用如图所示装置,选用不同可燃物测定空气里氧气的含量。实验起始时在集气瓶中装入少量水,并将水面上方空间分为五等份。将燃烧匙内的可燃物加热至燃烧或红热后,伸入瓶中塞紧瓶塞。冷却至室温后打开弹簧夹,记录数据如下表(装置的气密性良好)。
实验编号 | 可燃物 | 进入集气瓶中水的高度 |
① | 镁带 | 等于3格 |
② | 铁丝 | 几乎为0 |
③ | 红磷 | 约为0.6格 |
④ | 红磷 | 约为1.5格 |
下列有关解释不合理的是
A.实验①可能原因是:镁带除与氧气反应外,还能与空气中的其他气体反应
B.实验②可能原因是:铁丝燃烧消耗的氧气与生成的气体体积相等
C.实验③可能原因是:红磷量太少,集气瓶中的氧气未完全反应
D.实验④可能原因是:红磷点燃后,插入燃烧匙时,未迅速塞紧瓶塞,有部分空气逸出
【题目】一定质量的某纯净物Z与16.0g氧气恰好反应,生成X、Y、W的质量分别为8.8g、5.6g和l0.8g。反应中除氧气外,相关物质的部分信息如下表所示,其中![]() 表示碳原子,
表示碳原子,![]() 表示氧原子,
表示氧原子,![]() 表示氢原子。下列有关说法错误的是
表示氢原子。下列有关说法错误的是
物质 | X | Y | Z | W |
分子微观示意图 |
|
| —— |
|
相对分子质量 | —— | —— | 46 | —— |
A.Z的化学式为C2 H6 O
B.参加反应的Z的质量为9.2 g
C.该反应中Z和O2的化学计量数之比为1:3
D.反应中所涉及的物质均含有氧元素,且共有三种物质属于氧化物
【题目】“黄铜”是铜和锌的合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下。(烧杯质量均为56.5克)
1 | 甲 | 乙 | 丙 |
烧杯+稀盐酸质量 | 98.0g | 93.0g | 93.0g |
加入黄铜样品质量 | 10.0g | 12.0g | 10.0g |
充分反应后,烧杯+剩余物质质量 | 107.9g | 104.9g | 102.9g |
请回答下列问题:
(1)_____同学用的稀盐酸和黄铜样品恰好完全反应,他制取的氢气的质量是_____。
(2)计算黄铜样品中锌的质量分数_____(要求写出计算过程)。
(3)计算盐酸的质量分数为_____。
【题目】如图所示,若先将滴管甲中的液体滴入烧杯甲中,观察到气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体滴入烧杯乙中,气球又明显鼓起,用下列各组物质进行试验能够观察到上述现象的是( )
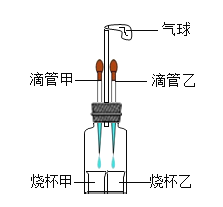
选项 | 滴管甲 | 烧杯甲 | 滴管乙 | 烧杯乙 |
A | 双氧水 | 二氧化锰 | 水 | 氢氧化钠固体 |
B | 稀硝酸 | 碳酸氢钾 | 盐酸 | 氢氧化钠溶液 |
C | 稀硫酸 | 铁 | 盐酸 | 碳酸钠 |
D | 石灰水 | 稀盐酸 | 水 | 硝酸铵 |
A.AB.BC.CD.D