题目内容
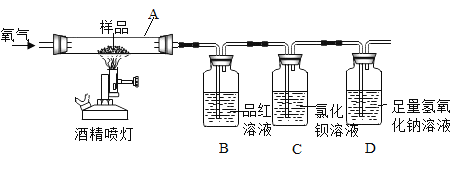
【题目】资料显示:在一定温度下,往煤中加入适量石灰石粉,其分解产物可使煤(含S)燃烧时产生的SO2转化成CaSO4,从而减少SO2排放,该方法被称为钙基固硫。某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。
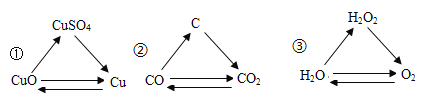
①SO2与CO2为非金属氧化物,均能与碱溶液反应,但SO2有毒,能与品红作用使其褪色。
②2SO2+2H2O+O2+2BaCl2=2BaSO4↓+4HCl
③CO2不与BaCl2溶液反应
(实验一)取S粉与CaCO3粉末的混合物装入A中,连续通入过量O2,加热至500℃左右,充分反应后,发现B中红色消失、C中出现大量的白色浑浊。
(1)停止实验的正确操作是_____。
(2)装置D中NaOH的作用是_____。
(实验二)另取上述S粉与CaCO3粉末的混合物装入A中,连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应后,发现B中红色消失,C中出现少量的白色浑浊。
(3)取反应后D中溶液滴加过量盐酸,出现大量无色气泡(其中有CO2)。反应结束后,经实验检验A中余下固体含有CaSO4,由此得知实验二过程中,A中发生的反应有三个,请完成剩余的两个化学方程式:
①S+O2![]() SO2;
SO2;
②_____;
③_____。
(实验三)另取CaSO4粉末装入A中,连续通入过量O2,加热至1200℃左右,充分反应,发现B中红色消失。
(4)比较实验一、二、三可知,如用该方法固硫,适宜的温度条件是_____。
【答案】停止加热,继续通入O2至A冷却 吸收多余的SO2气体,防止有毒气体污染环境 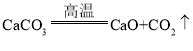
 1000℃左右,不超过1200℃
1000℃左右,不超过1200℃
【解析】
(1)为了防止停止加热后,内部温度降低,压强下降,造成外部大气压将液体压入导管内,引起倒吸,导致加热试管炸裂的现象发生,反应结束后,停止加热后继续通入氧气,使内部气体增多,压强不下降,避免倒吸现象发生,直至温度降至室温,达到内外压强一致即可,所以停止加热后继续通入O2至A冷却;
(2)硫粉在通入氧气后,生成二氧化硫,由于二氧化硫具有毒性,不得直接排入大气,所以采用氢氧化钠溶液吸收多余的二氧化硫,避免造成环境污染,所以装置D中氢氧化钠作用为吸收多余的SO2气体,防止有毒气体污染环境;
(3)题目信息给出有二氧化碳生成,能提供二氧化碳的只有碳酸钙,其在高温下分解生成氧化钙、二氧化碳,而A中有硫酸钙,说明还发生了氧化钙、二氧化硫和氧气反应生成硫酸钙的反应,只能如此才能保证质量守恒定律,所以另外两个反应为碳酸钙高温分解生成氧化钙和二氧化碳,即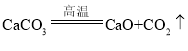 ,还有氧化钙、二氧化硫和氧气在高温条件下反应生成硫酸钙,即
,还有氧化钙、二氧化硫和氧气在高温条件下反应生成硫酸钙,即 ;
;
(4)根据题目信息可知,硫酸钙在1200℃时分解生成了二氧化硫,将起不到固硫的作用,所以加热温度不得高于1200℃,而在500℃时,出现大量白色沉淀,说明生成二氧化碳较多,碳酸钙没有被充分利用,1000℃时生成沉淀极少,说明石灰石充分吸收二氧化硫,因此最佳温度为1000℃左右,不得超过1200℃。

 名校课堂系列答案
名校课堂系列答案【题目】某同学利用如图所示装置,选用不同可燃物测定空气里氧气的含量。实验起始时在集气瓶中装入少量水,并将水面上方空间分为五等份。将燃烧匙内的可燃物加热至燃烧或红热后,伸入瓶中塞紧瓶塞。冷却至室温后打开弹簧夹,记录数据如下表(装置的气密性良好)。
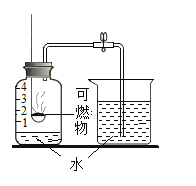
实验编号 | 可燃物 | 进入集气瓶中水的高度 |
① | 镁带 | 等于3格 |
② | 铁丝 | 几乎为0 |
③ | 红磷 | 约为0.6格 |
④ | 红磷 | 约为1.5格 |
下列有关解释不合理的是
A.实验①可能原因是:镁带除与氧气反应外,还能与空气中的其他气体反应
B.实验②可能原因是:铁丝燃烧消耗的氧气与生成的气体体积相等
C.实验③可能原因是:红磷量太少,集气瓶中的氧气未完全反应
D.实验④可能原因是:红磷点燃后,插入燃烧匙时,未迅速塞紧瓶塞,有部分空气逸出