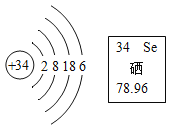
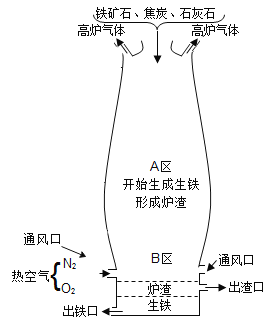
题目内容
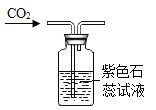
【题目】如图所示,若先将滴管甲中的液体滴入烧杯甲中,观察到气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体滴入烧杯乙中,气球又明显鼓起,用下列各组物质进行试验能够观察到上述现象的是( )
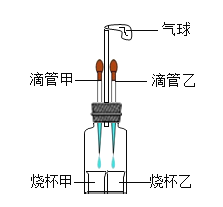
选项 | 滴管甲 | 烧杯甲 | 滴管乙 | 烧杯乙 |
A | 双氧水 | 二氧化锰 | 水 | 氢氧化钠固体 |
B | 稀硝酸 | 碳酸氢钾 | 盐酸 | 氢氧化钠溶液 |
C | 稀硫酸 | 铁 | 盐酸 | 碳酸钠 |
D | 石灰水 | 稀盐酸 | 水 | 硝酸铵 |
A.AB.BC.CD.D
【答案】B
【解析】
A、滴管甲中的双氧水加入盛有二氧化锰的烧杯甲中,两者反应放出氧气,使装置内部气体增多,压强增大,为了平衡压强,气球变大,但是氧气不能溶于氢氧化钠溶液中,内部压强不能减少,所以气球不再变小,选项A不符合题意;
B、滴管甲中稀硝酸加入盛有碳酸氢钾的烧杯甲中,两者反应放出二氧化碳,气体增多,内部压强增大,气球为了平衡压强,体积膨胀变大,而二氧化碳又可以被烧杯乙中氢氧化钠吸收生成碳酸钠,气体减少,内部压强减低,气球体积变小,而当滴管乙中盐酸在加入烧杯乙之后,盐酸又与碳酸钠反应放出二氧化碳,气体增多,压强增大,气球体积又变大,所以B符合题意;
C、滴管甲中稀盐酸加入盛有铁的烧杯甲中,两者反应放出氢气,气体增多,内部压强增大,气球体积变大,而氢气不能溶于碳酸钠,所以气球体积不变小,而当滴管乙中盐酸再加入烧杯乙中,盐酸与碳酸钠反应放出二氧化碳,气体进一步增多,压强再增大,气球体积变得更大,所以C不符合题意;
D、滴管甲中石灰水与烧杯甲中的盐酸发生酸碱中和反应,可以使内部温度升高,压强增大,气球体积变大,当反应结束后,温度降低,压强减小,气球体积变小,而当滴管乙中水加入盛有硝酸铵的烧杯乙中时,溶解是个吸热过程,内部温度降低,压强减小,气球不会变大,而是被压瘪,选项D不符合题意。故选B。

【题目】某实验小组的同学为了测定实验室中高锰酸钾样品的纯度,取20g该样品,依次加热该混合物,t1、t2、t3、t4时间后,称得剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 19.88 | 19.56 | 19.36 | 19.36 |
试计算:(1)加热__________时间后高锰酸钾已经完全反应。
(2)完全反应后产生氧气的质量为_________g。
(3)求该样品中高锰酸钾的质量分数_______。
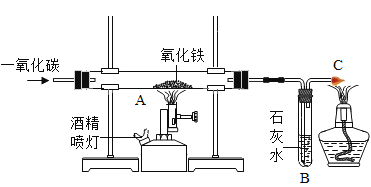
【题目】老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种。同学们对该粉末进行了研究。
(1)
实验方案 | 实验现象 | 实验结论 |
取少量红色粉末放入试管中,滴加足量的稀盐酸振荡 | 红色粉末全部消失,溶液呈棕黄色 | 粉末为Fe2O3 |
粉末为Cu |
写出“红色粉末全部消失”发生反应的化学方程式_______。
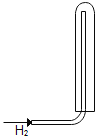
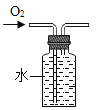
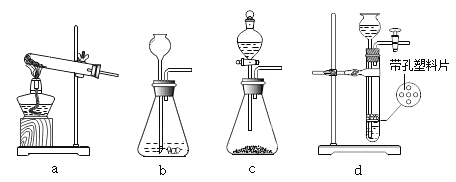
(2)取该粉末放入硬质玻璃管中,先通CO,然后再用酒精喷灯加热一段时间,停止加热继续通入CO至装置冷却。实验装置如图:
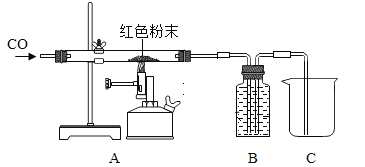
①实验时,先通CO再加热的目的是_________。
②若该粉末全部是氧化铁,在硬质玻璃管中观察到的实验现象是_________。B装置是用于吸收二氧化碳并收集CO,其中盛放的试剂最好是__________。
A NaOH 溶液 B 稀盐酸 C 水
③如果该实验没有装置B、C,实验造成的危害是_______。
【题目】某化学兴趣小组利用电子天平对某种铁铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入28.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
操作 | 空烧杯 | 加入硫酸后 | 加入合金后5分钟 | 加入合金后12分钟 | 加入合金后21分钟 | 加入合金后40分钟 | 加入合金后3小时 |
读数(g) | 28.0 | 155.8 | 183.6 | 183.4 | 183.2 | 183.0 | 183.0 |
(1)根据电子天平读数和时间的关系分析,该反应进行过程中,氢气的产生速度有什么特点?__________。
(2)完全反应后,产生氢气的质量为____________克
(3)合金中铜的质量分数为多少_________________?