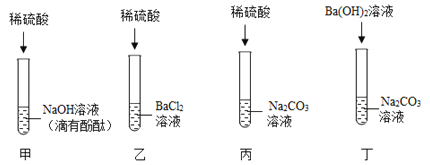
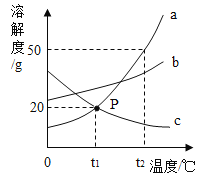
【题目】分析下表中NaCI和KNO3的溶解度数据,回答相关问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
KNO3 | 13.3 | 31.6 | 63.9 | 110.0 | 169.0 | 246.0 | |
(1)20°C时,NaCl 的溶解度为______g。
(2)在NaCl和KNO3中溶解度受温度变化影响较大的是________。
(3)将10g NaCl和55g KNO3分别溶于相同质量的60°C的水后,再降温到20°C。
①要使55g KNO3完全溶解,至少需要_____g 60°C的水;
②将上述两溶液均降温到20°C时,有晶体析出的是_______。
【题目】将20g稀盐酸逐滴加入装有40g质量分数为10%的氢氧化钠溶液的烧杯中,随着稀盐酸滴加,杯内溶液pH变化如图所示,温度变化如表所示(不考虑反应过程中热量散失)。

反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是 ℃。
(2)计算恰好完全反应时,所得溶液溶质质量为多少?
【题目】某实验小组选择“铜和硫酸反应的探究”的课题开展探究,下表是他们分别用相同质量的铜粉和足量硫酸反应的几组实验数据:
实验编号 | 硫酸的质量分数/% | 温度/℃ | 铜粉消失的时间/s |
① | 98 | 120 | 400 |
② | 98 | 200 | 200 |
③ | 80 | 120 | 500 |
④ | 80 | 200 | 280 |
⑤ | 70 | 200 | 不消失 |
⑥ | 40 | 200 | 不消失 |
(1)实验①、②表明:该反应快慢与__________有关,其关系是_______________;能表明硫酸浓度对反应快慢有影响的实验编号组合是_____________。
(2)如果把实验①中硫酸的质量分数改为85%,请你推出铜粉消失时间(用t表示)的取值范围_______。
(3)从上表来看,能与铜粉发生反应的硫酸溶液最低浓度a%的范围是_________(取整数)。
(4)影响金属和酸化学反应速度的因素除了上述因素以外还可能有____________________。
(拓展延伸)已知浓硫酸与铜粉加热时产生刺激性气体氧化物,同时溶液变蓝。如图是利用压强传感器测定浓硫酸与铜粉加热产生气体与NaOH溶液产生喷泉实验过程及压强变化曲线图。
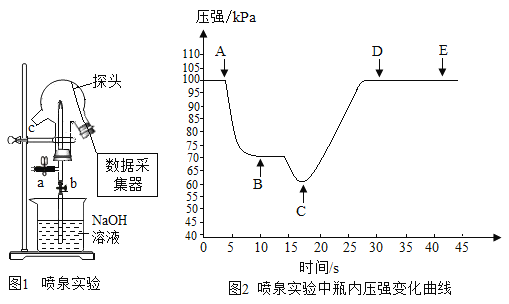
(5)请写出铜粉与浓硫酸加热生成刺激性气体和溶液变蓝的化学方程式_________________。
(6)实验过程:三颈瓶内装有收集满的气体,采集数据,将吸有NaOH溶液的胶头滴管塞紧颈口c,挤尽胶头滴管液体,然后打开阀门b,烧杯内的NaOH溶液喷到三颈瓶内形成喷泉,则曲线AB段下降的原因是_____________;CD段上升的原因是___________________。