题目内容
【题目】下图中A是钾元素在元素周期表中的信息,B、C、D、E依次是钠、镁、铝、钾的原子结构示意图。
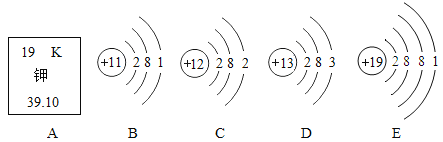
(1)由A可知,钾元素的相对原子质量为________。
(2)分析B、C、D、E可知:
①它们属于不同种元素的根本原因是它们的___不同;
②根据___判断,B. C. D. E都属于金属元素;
③在元素周期表中,钠、镁、铝元素位于同一周期,是因为它们具有相同的____;
④由于钾原子比钠原子多1个___,更容易失去电子,所以钾的活动性比钠强。
【答案】39.10 核内质子数 最外层电子数 电子层数 电子层
【解析】
(1)在元素周期表中,元素名称下方的数字表示相对原子质量,故钾的相对原子质量为39.10;
(2)①质子数不同元素种类不同,它们属于不同种元素的根本原因是核内质子数不同;
②金属原子最外层电子数小于4个,易失去电子,形成稳定结构,故根据最外层电子数可判断,B. C. D. E都属于金属元素;
③电子层数决定周期数,在元素周期表中,钠、镁、铝元素位于同一周期,是因为它们具有相同的电子层数;
④钾的金属活动性比钠强,根本原因为钾原子的电子层比钠原子多1个电子层。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
【题目】某兴趣小组对石灰石样品进行如下实验取 12g 样品放入烧杯中,将 100g 稀盐酸分 4 次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:第 4 次加入稀盐酸后所得溶液中 CaCl2的质量分数。(写出计算过程,最终结果保留 0.1%)。