【题目】金属、氧化物、酸、碱、盐之间能相互发生反应,某化学兴趣小组进行系列实验
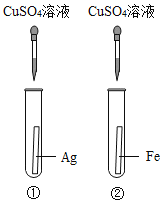
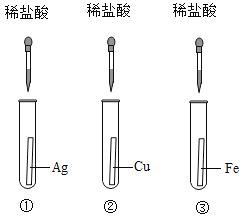
实验一:为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。
方案A | 方案B |
|
|
(1)能验证三种金属活动性顺序的方案是_____(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是_____。
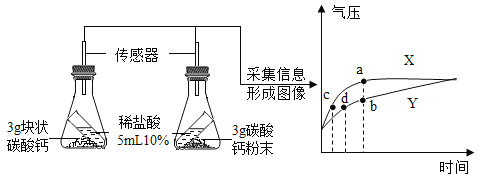
实验二:实验室用锌粒和稀硫酸反应制取氢气,若13克锌与足量的稀硫酸反应,计算产生氢气的物质的量。(根据化学方程式列式进行计算)_____
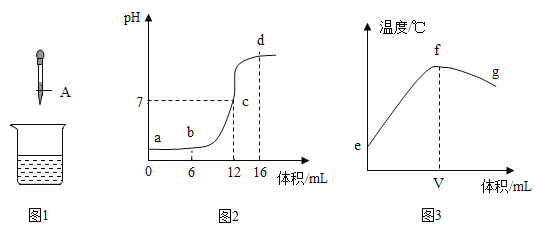
实验三:为研究碳酸钠、氢氧化钙、盐酸的化学性质,进行如下实验。
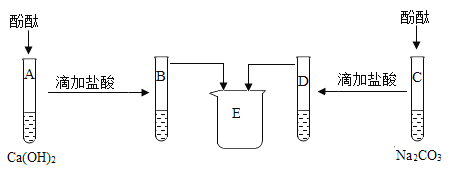
(1)A、C中酚酞均变_____色,证明Na2CO3和Ca(OH)2溶液呈碱性。
(2)B、D试管内的物质在烧杯E中混合产生白色沉淀,白色沉淀的化学式为_____,由此能否说明B中有反应物剩余?请你判断及说明理由_____,E中的溶质除酚酞外,一定含有的是_____(填化学式),可能含有的是_____(填化学式)。
【题目】根据表中数据,回答问题
温度/℃ 溶解度g/100g水 物质 | 0 | 20 | 40 | 60 |
KNO3 | 13.3 | 32.0 | 63.9 | 110 |
NaC1 | 35.7 | 36.6 | 37.3 | 38.4 |
10℃时,将固体KNO3、NaCl各20g分别放到盛有100g水的①、②两个烧杯中,充分溶解后,恢复到10℃,现象如图,请结合图示回答下列问题:
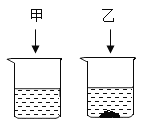
(1)能说明固体甲是NaCl的证据是_____。
(2)下列关于10℃时,甲、乙所得溶液的说法正确的是_____(填编号)。
A 溶液中溶质质量:烧杯①>烧杯②
B 烧杯②中溶液是饱和溶液,无法确定烧杯①中溶液是饱和溶液还是不饱和溶液。
C 将两个烧杯中溶液升温至20℃时,溶质质量分数烧杯①=烧杯②
D 若将烧杯①和烧杯②中物质全部混合,温度保持10℃,则仍有固体未全部溶解。
(3)40℃时,100克水中溶解了40克KNO3,恒温蒸发掉_____克水时(结果精确到0.1),开始析出晶体。
(4)当KNO3中混有少量NaCl时,提纯KNO3采用的方法是_____(填“蒸发结晶”或“降温结晶”)。
(5)现将经提纯的KNO3用于配制一定溶质质量分数的溶液,实验中用到的仪器除了电子天平、药匙、烧杯、玻璃棒、试剂瓶、标签外,还需用到的仪器有_____。