题目内容
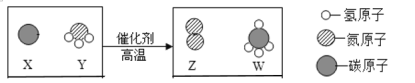
【题目】我国科研团队率先提出“单原子催化”概念。单原子催化剂用于合成气制造燃料甲醇(CH3OH)的微观示意图如图所示。

(1)A、B、C中属于单质的是_________(填字母序号)。
(2)反应中A与B的分子个数比为__________。
【答案】B 1:2
【解析】
由图中信息可知,一氧化碳和氢气在单原子催化剂作用下反应能生成甲醇,反应的化学方程式为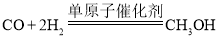 。
。
(1)由同种原子构成的分子属于单质的分子,由不同种原子构成的分子属于化合物的分子,由上分析可知A分子中含有碳、氧原子,属于化合物;B分子中只含有氢原子,属于单质;C分子中含有碳、氢、氧三种原子,属于化合物;则属于单质的是B;
(2)由上分析可知反应中A与B的分子个数比为1∶2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】阅读下面科普短文(原文作者:许谦,有删改)
酸奶口感酸甜,营养丰富,是深受人们喜爱的一种乳制品。与普通牛奶比较,酸奶中的蛋白质和钙更易被人体消化吸收,是乳糖不耐症患者的良好食品。
通常的酸奶是将牛奶发酵而制成的。牛奶中主要含有蛋白质、乳糖和脂肪。在发酵过程中,乳酸菌把乳糖(C12H22O11)转化成乳酸(C3H6O3),使得牛奶的酸度升高。随着酸度增加,蛋白质分子互相连接,形成了一个巨大的“网络”,这个“蛋白质网络”把乳糖、水、脂肪颗粒都“网”在其中。所以,奶变“粘”、变“酸”了。

酸奶中含有大量活力较强的乳酸菌。乳酸菌可抑制某些腐败菌和病原菌的繁殖,从而维持人体内,尤其是肠道内正常的微生态平衡,促进食物的消化吸收。酸奶在储藏和配送过程中,乳酸菌的数量会因乳酸的过量积聚而明显减少,而酸奶的乳酸积聚又会影响到酸奶的酸度。有研究者选取某种市面常见的酸奶进行实验,数据如下表所示。
表某品牌酸奶酸度的变化
温度/℃ 时间/天酸度/°T | 4 | 28 | 37 |
0 | 67.7 | 67.7 | 67.7 |
2 | 73.9 | 77.1 | 79.2 |
4 | 76.4 | 82.7 | 86.3 |
6 | 85.5 | 92.2 | 98.9 |
8 | 90.2 | 98.7 | 113.2 |
1999年颁布的国标GB2746-1999中,对成品酸奶的酸度规定为“酸度不小于70°T”。按照一般人的接受程度,酸奶酸度不能超过100°T。
依据文章内容回答下列问题。
(1)乳酸是由乳糖转化生成的,请比较二者的化学式,分析它们的相同点和不同点。
相同点:_____。
不同点:_____。
(2)实验中所用酸奶若在37℃条件下储存,_____天后,酸度一定会超出一般人的接受程度。(填字母序号,下同)
A 2 B 4 C 5 D 8
(3)由表中实验数据可知,影响酸奶酸度的因素有_____。
(4)下列关于酸奶的说法正确的是_____。
A 酸奶适用于乳糖不耐症患者食用
B 酸奶放置时间越长,乳酸菌含量越高
C 酸奶中的乳酸菌对人类身体有害无益
D 酸奶变“粘”与蛋白质分子相互连接形成巨大“网络”有关
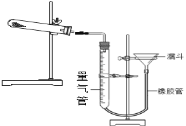
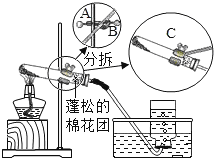
【题目】2019年苏州市初中化学实验考查内容是“用高锰酸钾制取氧气”(装置图如下),下面是某同学在本次实验过程中填写的部分实验报告,请回答有关问题:
实验步骤 | 有关问题 |
⑴检查气体发生装置的气密性。 | 检查装置气密性的具体操作及气密性良好的判断依据是_____。 |
⑵向试管中加入少量高锰酸钾粉末,使其平铺于试管底部,按上图所示组装实验装置。在接近试管口的地方放置一小团蓬松的棉花团。 | ①用药匙或纸槽向试管中加入少量高锰酸钾粉末。 ②组装实验装置时,要根据___的高度将盛有药品的试管固定在铁架台上。 ③欲调整装置中试管的倾斜角度,应调节图中A、B、C哪个旋钮:___旋钮。 ④试管口棉花团的作用是____。 |
实验步骤 | 有关问题 |
⑶加热试管,当导管口有连续均匀气泡冒出时,开始收集气体。 | ①加热试管的方法是____。 ②发生反应的化学方程式为____。 ③收集满瓶氧气的操作过程是:等集气瓶中的水排完后,一只手扶稳集气瓶,另一只手首先小心地将导管从瓶口移开,然后___,最后把集气瓶正放在桌子上。 |
⑷气体收集完毕后,操作B | 操作B是先____,再_____ |
⑸收集完气体后,测得其纯度明显偏低,其原因可能是____(填字母)。
A 高锰酸钾中混入了二氧化锰 B 收集前,集气瓶中未注满水
C 收集后,集气瓶中仍留有水 D 未见气泡连续均匀冒出时就开始收集
⑹选择排水法收集一瓶氧气,供“铁丝在氧气中燃烧”实验使用的理由是____。
⑺)加热3.16g高锰酸钾固体一段时间,若高锰酸钾中的氧元素有1/4转化为氧气,则生成的氧气的质量为____,剩余固体中氧元素的质量分数为____。(精确到0.1%)
⑻林同学称取一定质量高锰酸钾制取一定质量的氧气,将温度控制在250℃加热制O2,实验结束时,林同学发现在用高锰酸钾制取氧气的实验中,收集到的O2大于理论产量,针对这一现象,同学们在老师的指导下进行了如下探究:
(提出猜想)依据质量守恒定律,他们做出如下猜想:
猜想Ⅰ:反应生成的MnO2分解放出O2
猜想Ⅱ:反应生成的K2MnO4分解放出O2
(实验验证)同学们分为两组,分别进行以下实验:
①第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变。则猜想____错误。
②第二组同学取一定质量的K2MnO4在250℃条件下加热,固体质量____(填“减轻”或“增重”),得出了猜想Ⅱ正确的结论。
林同学提出:不用测定质量也能验证以上猜想是否正确,林同学选择的实验方法可能是____。
(拓展延伸)实验发现,K2MnO4受热只能部分分解,经分析可能是K2MnO4分解的生成物K2O对其分解产生影响。为验证此结论,设计如下实验方案:
①分别取K2MnO4固体于两支试管中,一支试管中加入K2O,一支试管中不加K2O。
②加热,用相同规格的集气瓶,用排水法分别收集一瓶气体。③比较所用的时间长短,以确定锰酸钾的分解是否与氧化钾有关系。该过程中还必须控制相同的变量是______。