题目内容
【题目】中和反应是一类重要的化学反应。某同学利用图1实验研究稀盐酸与氢氧化钠液反应的过程,并测量反应过程中溶液的pH和温度的变化情况,得到图2和图3
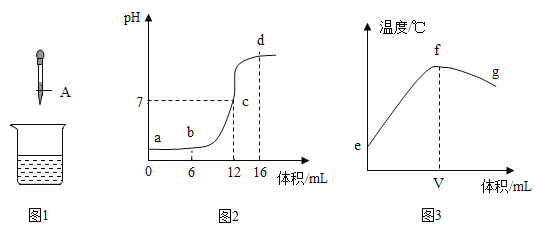
(1)烧杯中发生反应的化学方程式为_____;
(2)滴管A中溶液的溶质是_____(填化学式);
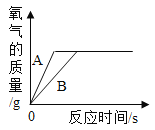
(3)结合图2中有关信息可知图3中V的数值最接近_____(填“6”、“12”或“16”);
(4)下列说法正确的是_____。
A 图2中b点所示溶液中的溶质是NaCl和HCl
B 取图2中d点所示溶液加热蒸干所得固体为纯净物
C 图2中c→d所示溶液中NaCl的质量不断增加
D 图3中e→f变化趋势可说明该反应是放热反应
【答案】![]() NaOH 12 AD
NaOH 12 AD
【解析】
(1)烧杯中发生反应为稀盐酸与氢氧化钠生成氯化钠和水,化学方程式为NaOH + HCl =NaCl + H2O;
(2)由图2可知,溶液的pH逐渐增大,可知是将氢氧化钠溶液滴入盐酸中,滴管A中溶液的溶质是氢氧化钠;
(3)中和反应放热,图3中V对应的温度最高,说明氢氧化钠和盐酸刚好完全反应,溶液的pH为7,结合图2可知,数值最接近12;
(4)A、图2中b点所示溶液中pH<7溶液呈酸性,盐酸有剩余,溶液中的溶质是NaCl和HCl,选项正确;
B、图2中d点氢氧化钠过量,所示溶液溶质是氯化钠和氢氧化钠,加热蒸干所得固体为氯化钠、氢氧化钠,为混合物,选项错误;
C、在c点盐酸和氢氧化钠恰好完全反应,c→d所示溶液中,氯化钠的质量不会增加,选项错误;
D、图3中e→f溶液温度不断升高,变化趋势可说明该反应是放热反应,选项正确。
故选AD。

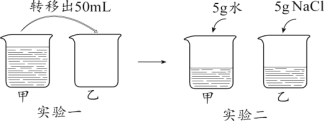
【题目】某同学进行下图两个实验。
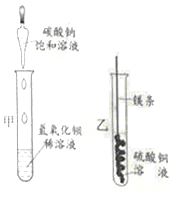
(l)甲实验中反应的化学方程式为____________;
(2)乙实验观察到的现象是___________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
【提出猜想】 白色沉淀为:Ⅰ._______;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3.
【实验方案】
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为____________。 ②若______且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________,猜想Ⅲ成立。 |
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时___________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是__________________。
【题目】啤酒盖(主要成分为铁)生锈直接影响啤酒厂家的市场销售和品牌形象。某小组同学用铁钉代替啤酒盖模拟其生锈实验,探究铁生锈的条件及影响生锈速率的因素。
I.探究铁生锈的条件
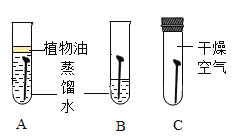

(1)证明铁生锈需要与氧气接触的实验现象是____。
II.探究影响铁生锈速率的因素
(查阅资料)啤酒的pH值大约在3.8~4.6之间
(猜想假设)铁钉生锈可能与溶液酸碱度、温度、是否杀菌有关。
实验1:分别取铁钉浸于等体积液体中,在空气中放置相同时间进行如下实验:
实验 | 是否杀菌 | pH值 | 温度/℃ | 锈蚀情况/% |
① | 杀菌 | 6 | 20 | 无现象 |
② | 杀菌 | 6 | 70 | 较明显生锈 |
③ | 未杀菌 | 6 | 70 | 明显生锈 |
④ | 未杀菌 | 6 | 20 | 略微生锈 |

实验2:在70℃时,将杀菌后的铁钉于等体积溶液中,在空气中放置相同时间进行如下实验:
实验 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
pH值 | 3 | 5 | 7 | 9 | 11 |
锈蚀情况 | 完全生锈 | 明显生锈 | 略微生锈 | 无现象 | 无现象 |
(解释与结论):
(2)由实验1得出“温度与铁生锈速率有关”的结论,依据的两个实验是__(填编号)
(3)实验2的目的是_______。
(4)由实验1和实验2推知影响铁生锈的因素是_____
(反思与评价)
(5)实验2没有进行pH=13的实验,理由是 ___。
(6)结合本题请分析啤酒盖易生锈的原因是 ______