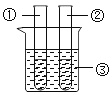
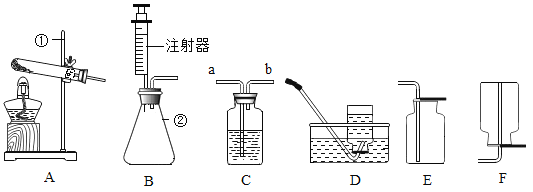
【题目】实验室常用高锰酸钾制取氧气,可能用到的装置如图所示。
(1)本实验可选用的发生和收集装置为________(填字母)。
(2)取一定量的高锰酸钾固体,充分加热,发现实际产生氧气量远高于理论值,则可能的原因有________(测定过程中产生的误差可忽略)。
(3)某同学进行该实验并用排水法收集O2.下列操作正确的是__(填字母)
A 未检查装置气密性即向大试管中加入高锰酸钾固体
B 当导管口有连续气泡均匀冒出时,开始收集氧气
C 集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面
D 气体收集完毕后,先熄灭酒精灯,再将导管移出水面
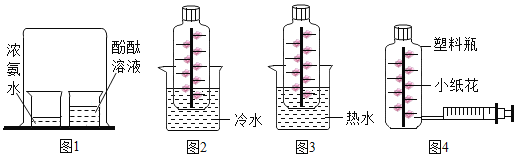
(4)实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10%的双氧水(其他实验条件均相同),测定收集500mL氧气所用的时间,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
MnO2用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 |
所用时间/s | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 | 2 |
①写出上述反应的符号表达式: ________,该反应的基本类型是__________。
②该实验可得出的结论是______________。
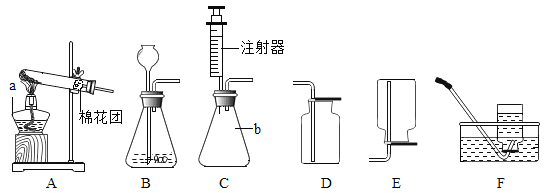
③若上述实验选用B做发生装置,也可以制取氧气则长颈漏斗下端管口必须浸没在液体中,原因是_______。若选用C做发生装置,你认为选用装置C的优点是____________。
④在实验中也可以将注射器连接到装置B的导管口处,用来_________。
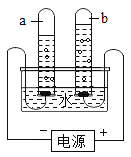
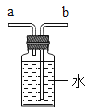
(5)实验室需少量甲烷气体,可用加热无水醋酸钠与碱石灰两种固体混合物制得。制甲烷气体的发生装置应选用________(填字母)装置,收集甲烷气可选用E或F装置,由此推断甲烷气具有的物理性质是_____________,若用如图装置收集该甲烷,气体由______端通入(填“a”或“b”)
(6)在实验室里制取氧气,既可采用分解过氧化氢的方法,也可采用分解氯酸钾的方法。上述两种方法的主要共同点有___________。
①采用MnO2均可改变其反应速率 ②反应都不需加热
③都利用含氧物质的分解来达到目的 ④两种方法所需仪器相同。
A ①③ B ③ ④ C ①② D ②④
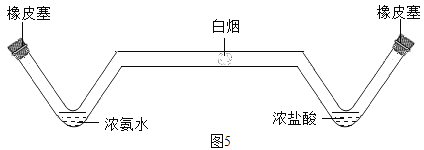
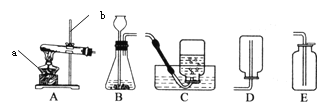
(7)某同学在学习了MnO2对H2O2的分解的催化作用之后,对催化剂产生了浓厚的兴趣。于是,他设计下表所示实验,探究金属铜对H2O2分解速率的影响。
操 作 | 装 置 | 现 象 |
1.取一个铜丝网,卷成筒形,固定在铁丝上。 |
| |
2.分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中。 |
| 约1min后可观察到①和②中都有少量气泡产生。 |
3.把铜丝网插入①中。 |
| ①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生。 |
回答下列问题:
(a)仪器②在实验中的目的是_____________
(b)能否可以得出铜可以加快H2O2分解的速率_______(填“是”或“否”)理由是_______。
(c)如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是_____。
A 称量实验前铜丝网的质量并将实验后的铜丝网干燥称重
B 向仪器②中加入二氧化锰
C 将实验后的铜丝网插入AgNO3溶液中(已知铜可以和AgNO3溶液反应生成银白色固体)
D 将铁丝换成铜丝
E 将过氧化氢溶液稀释
(d)该同学查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是___________。
A MnO2只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质不可能是其他反应的反应物或生成物
【题目】做完“铁在氧气里燃烧”的实验后,某兴趣小组有一些疑惑不解的问题,于是进行了以下探究
【问题1】细铁丝在氧气中燃烧为什么会火星四射?
【资料1】铁制品一般含有少量碳,含碳细铁丝燃烧时,炭粒生成的二氧化碳在熔融态物质中形成气泡,熔融态物质因气泡炸裂引起火星四射现象.
【设计实验】为了探究火星四射现象的原因,该小组同学设计的实验方案:
【实验探究1】小明做细铁丝在氧气中燃烧的实验:
但不见铁丝燃烧,反复实验均未成功.写出导致该同学实验失败的可能原因(两个): 。
经过改进,该同学完成了该实验,写出反应的文字或符号表达式 。
【问题2】铁燃烧时溅落下来的黑色物质中还有没有铁?
【资料2】自然界中铁的氧化物主要有Fe2O3和Fe3O4两种(Fe2O3为暗红色,FeO极易氧化)。
【实验探究2】将冷却后的黑色物质碾碎,经实验,说明溅落下来的黑色物质中还有铁。
【问题3】铁燃烧的产物为什么不是Fe2O3呢?
【资料3】①Fe2O3和Fe3O4的分解温度见下表;②Fe2O3铁高温分解成Fe3O4
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 | |
熔点点/℃ | 1535 |
【理论讨论】根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温在 之间。
【拓展延伸】①Fe2O3高温分解成Fe3O4和一种气体,写出该反应的文字或符号表达式 ;
②有些超市的食品包装盒放有黑色的氧化亚铁粉末,若粉末的颜色 ,就说明包装盒漏气,售货员就能及时发现并处理。