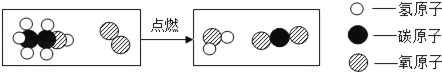
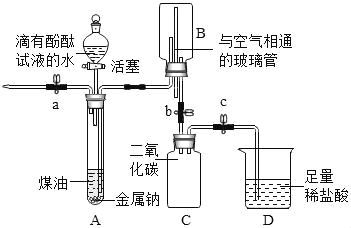
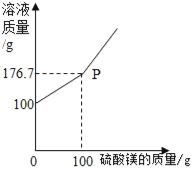
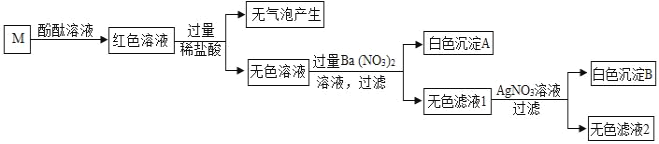
【题目】已知:煤油不与金属钠反应;煤油密度比水小且不溶于水;金属钠在空气中极易被氧化,常温下能与水剧烈反应生成氢氧化钠和氢气。化学兴趣小组同学设计了如图所示装置进行实验探究,有关实验操作及现象记录如下:
步骤 | 操 作 | 现 象 |
Ⅰ | 先打开a,再打开分液漏斗活塞。 待大试管A中充满液体后,立即 关闭a及分液漏斗活塞 | A中液体分层,油层在上;钠熔成银白色小球, 在液体的界面处剧烈反应,产生大量气泡; 下层溶液呈红色,并逐渐进入B中 |
Ⅱ | 打开b,待B中部分溶液进入C 中时关闭b,并打开a排气减压 | C中溶液仍呈红色 |
Ⅲ | 打开止水夹c | D中溶液进入C中,产生气泡,溶液变为无色 |
下列关于该实验的说法:
①步骤Ⅰ、Ⅱ中红色溶液呈碱性,步骤Ⅲ中 无色溶液呈中性
②本实验证明了二氧化碳能与氢氧化钠起反应
③装置D中若改用氯化钙溶液也能实现实验探究的目的
④步骤Ⅲ中,C装置内发生的化学反应是1个
⑤装置B中与空气相通的玻璃管的作用是维持内外气压平衡,使液体顺利地进出
以上说法中正确的是( )
A. ①②③B. ②③⑤C. ①④⑤D. ②④⑤
【题目】某兴趣小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略).
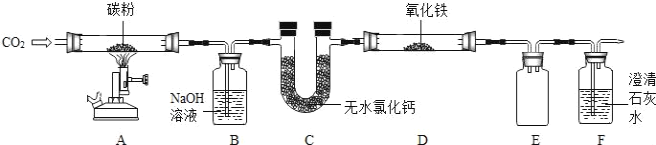
(1)F装置内溶液变浑浊的化学反应方程式为_____;A装置内发生的反应属于_____反应(选填放热或吸热).
(2)装置B的作用是_____.处理尾气的方法为_____.
(3)将该小组分为两组,各取48g氧化铁粉末按如图装置进行对比实验.甲组用酒精灯(火焰温度5000C~7000C)、乙组用酒精喷灯(火焰温度8000C~10000C)分别对装置D充分加热,红色粉末均变为黑色粉末.两组分别用固体产物进行实验,记录如下.
操作步骤 | 甲组现象 | 乙组现象 |
1.称量反应后粉末质量(g) | 44.2 | 33.6 |
2.取黑色粉末用磁铁吸引 | 部分能被磁铁吸引 | 全部能被磁铁吸引 |
3.取黑色粉末加入足量稀盐酸,震荡 | 部分溶解,无气泡 | 全部溶解,有气泡 |
为解释这个现象,小组成员查阅到下列资料:
Ⅰ.已知铁的氧化物有FeO、Fe3O4、Fe2O3,在一定条件下,均能失去或逐步失去其中的氧,最终被还原为铁.
Ⅱ.Fe3O4是一种铁氧体磁性物质,不溶于水和酸.
Ⅲ.氧化铁和一氧化碳进行热反应分析的相关数据图.
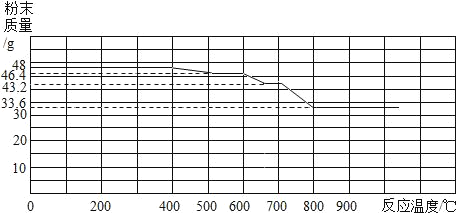
(分析与结论)
①乙组的固体产物是_____,产生气泡的化学方程式为_____.
②小军根据实验现象推测甲组的固体产物可能是_____.小华通过计算也证明了小军的观点.试通过计算说明他的推测依据._____
(反思与交流)
考虑到一氧化碳气体通入的不持续性,装置E的作用是_____.从实验安全的角度考虑,上图装置还要采取的改进措施是_____.