题目内容
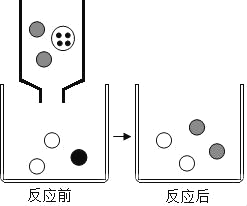
【题目】有一包固体,可能含有NaCl、NaOH、Na2CO3、Na2SO4、MgCl2中的一种或几种。为确定其组成,小明取少量固体加足量水溶解得到无色溶液M,进行如图所示实验。请回答下列问题:
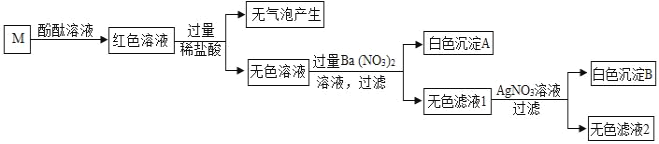
(1)白色沉淀A是_____ (填化学式)。
(2)原固体中一定不含的物质是_____。
(3)无色滤液2中一定含有的阳离子是_____(填离子符号)。
(4)上述实验可知还有一种物质不能确定是否存在,为进一步确定,应改进的方法是_____。
【答案】BaSO4 Na2CO3、MgCl2 Na+、H+、Ba2+ 方法一:将上述实验中的稀盐酸改成稀硝酸;
方法二:取原固体少量加足量水溶解,先加过量的稀硝酸,再加过量的Ba(NO3)2溶液,过滤,取滤液滴加适量的AgNO3溶液,如果产生白色沉淀,证明有NaCl。
【解析】
氢氧化钠、碳酸钠在溶液中显碱性,能使酚酞变红色,碳酸钠和酸反应会生成二氧化碳,氢氧化钠和氯化镁会生成氢氧化镁沉淀,硫酸根离子和钡离子会生成硫酸钡沉淀,氯离子和银离子会生成氯化银沉淀。所以M中滴加酚酞,溶液变红色,M中可能含有氢氧化钠、碳酸钠;滴加稀盐酸,无气泡产生,说明M中不含碳酸钠,含有氢氧化钠;氢氧化钠和氯化镁不能共存,所以M中不含氯化镁;无色溶液中滴加硝酸钡会生成白色沉淀A,所以M中含有硫酸钠,白色沉淀A是硫酸钡;无色滤液I滴加硝酸银会生成白色沉淀B,说明无色滤液I中含有氯离子,所以B是氯化银沉淀。
由此分析可知:(1)白色沉淀A是:BaSO4;
(2)通过推导可知,原固体中一定不含的物质是:Na2CO3、MgCl2;
(3)由于加入的稀盐酸和硝酸钡是过量的,所以无色滤液2中一定含有的阳离子是:Na+、H+、Ba2+;
(4)通过上述实验可知还有一种物质不能确定是否存在,盐酸会引入氯离子,对氯化钠的检验造成干扰,所以为进一步确定,应采用的方法是:方法一:将上述实验中的稀盐酸改成稀硝酸;
方法二:取原固体少量加足量水溶解,先加过量的稀硝酸,再加过量的Ba(NO3)2溶液,过滤,取滤液滴加适量的AgNO3溶液,如果产生白色沉淀,证明有NaCl。
故答案为:(1)BaSO4;
(2)Na2CO3、MgCl2;
(3)Na+、H+、Ba2+;
(4)方法一:将上述实验中的稀盐酸改成稀硝酸;
方法二:取原固体少量加足量水溶解,先加过量的稀硝酸,再加过量的Ba(NO3)2溶液,过滤,取滤液滴加适量的AgNO3溶液,如果产生白色沉淀,证明有NaCl。

 阅读快车系列答案
阅读快车系列答案【题目】已知碳酸钙在高温下可分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3![]() CaO+CO2↑,同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如下表:
CaO+CO2↑,同学们从山上采集到一种石灰石(主要成分为碳酸钙),他们取80g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量与反应时间的关系如下表:
反应时间∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为_____克。
(2)求该石灰石中含CaCO3的质量分数(写出计算过程)。_____
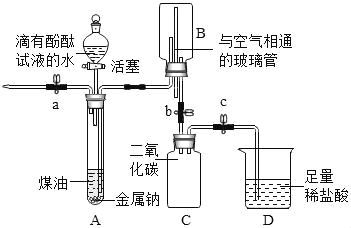
【题目】已知:煤油不与金属钠反应;煤油密度比水小且不溶于水;金属钠在空气中极易被氧化,常温下能与水剧烈反应生成氢氧化钠和氢气。化学兴趣小组同学设计了如图所示装置进行实验探究,有关实验操作及现象记录如下:
步骤 | 操 作 | 现 象 |
Ⅰ | 先打开a,再打开分液漏斗活塞。 待大试管A中充满液体后,立即 关闭a及分液漏斗活塞 | A中液体分层,油层在上;钠熔成银白色小球, 在液体的界面处剧烈反应,产生大量气泡; 下层溶液呈红色,并逐渐进入B中 |
Ⅱ | 打开b,待B中部分溶液进入C 中时关闭b,并打开a排气减压 | C中溶液仍呈红色 |
Ⅲ | 打开止水夹c | D中溶液进入C中,产生气泡,溶液变为无色 |
下列关于该实验的说法:
①步骤Ⅰ、Ⅱ中红色溶液呈碱性,步骤Ⅲ中 无色溶液呈中性
②本实验证明了二氧化碳能与氢氧化钠起反应
③装置D中若改用氯化钙溶液也能实现实验探究的目的
④步骤Ⅲ中,C装置内发生的化学反应是1个
⑤装置B中与空气相通的玻璃管的作用是维持内外气压平衡,使液体顺利地进出
以上说法中正确的是( )
A. ①②③B. ②③⑤C. ①④⑤D. ②④⑤