题目内容
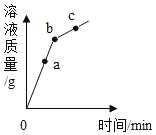
【题目】BaCl2是一种重金属盐,其水溶液具有很强的毒性,若误服了BaCl2溶液可立即服用MgSO4溶液解毒。为测定某BaCl2溶液的溶质质量分数,现向BaCl2溶液不断加入MgSO4溶液,并将反应过程中溶液总质量与加入MgSO4溶液的质量关系绘制成曲线如图所示,请回答:
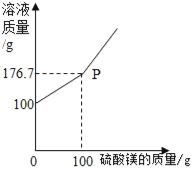
(1)P点时溶液中的离子有_____。
(2)求原BaCl2溶液的溶质质量分数。________
【答案】Mg2+和Cl- 20.8%
【解析】
加入100g硫酸镁出现明显的拐点,说明此时恰好完全反应。此时溶液为氯化镁,对应的离子有 Mg2+和Cl-。
根据质量守恒定律可得,生成硫酸钡的质量为100g+100g-176.7g=23.3g
解:设原BaCl2溶液的溶质质量分数为x
MgSO4+BaCl2=BaSO4↓+MgCl2
208 233
100gx 23.3g
![]()
x=20.8%
答:(1)P点时溶液中的离子有 Mg2+和Cl-。
(2)原BaCl2溶液的溶质质量分数为20.8%。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目