【题目】有一工业过程:电石(CaC2) ![]() 灰浆
灰浆 ![]() 残渣 其中电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑
残渣 其中电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑
(1)残渣中主要成分是Ca(OH)2和 . 工业上利用乙炔(C2H2)产生的灰浆和残渣制备化工原料KClO3和超细CaCO3 .
(2)Ⅰ.制备KClO3的流程如下: 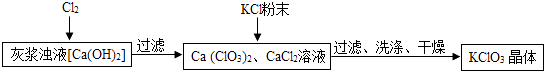
向灰浆浊液中通入Cl2 , 得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式 .
(3)有关物质在常温下的溶解度如下:
物质 | Ca(ClO3)2 | CalO3 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入KCl粉末,KCl与(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3晶体的原因是 .
(4)洗涤时,可选用下列洗涤剂(填字母编号). A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
(5)Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐): 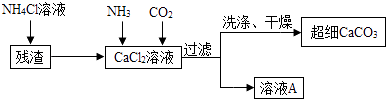
向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式 .
(6)流程中溶液A可循环使用,其主要成分的化学式是 .