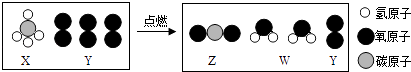
题目内容
【题目】下图为某化工企业生产流程示意图: 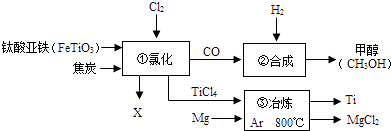
下列说法正确的是( )
A.钛酸亚铁(FeTiO3)中钛元素为+3价
B.①中反应为:2FeTiO3+6C+7Cl2 ![]() 2X+2TiCl4+6CO,则X为FeCl3
2X+2TiCl4+6CO,则X为FeCl3
C.③中氩气(Ar)作保护气,反应类型为置换反应
D.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2
【答案】BC
【解析】解:A、根据在化合物中元素化合价的代数和为零的原则,设钛元素的化合价为a,则(+2)+a+(﹣2)×3=0,a=+4,故A错误; B、根据质量守恒定律,化学反应前后原子的种类和个数不变,反应前Fe:2,Ti:2,O:6,C:6,Cl:14;反应后Fe:0,Ti:2,O:6,C:6,Cl:8;故2X中含有2个铁原子,6个氯原子,故X的化学式为:FeCl3;故B正确;
C、因为镁的化学性质活泼,故用镁和氯化钛冶炼钛时需要氩气做保护气,故C说法正确;
D、一氧化碳和氢气反应生成甲醇的化学方程式为
CO+ | 2H2═CH3OH |
28 | 4 |
一氧化碳与氢气的质量比为28:4=7:1,故D说法错误;
故选BC
【考点精析】解答此题的关键在于理解质量守恒定律及其应用的相关知识,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.

 世纪百通期末金卷系列答案
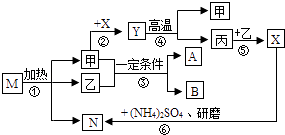
世纪百通期末金卷系列答案【题目】有一工业过程:电石(CaC2) ![]() 灰浆
灰浆 ![]() 残渣 其中电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑
残渣 其中电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑
(1)残渣中主要成分是Ca(OH)2和 . 工业上利用乙炔(C2H2)产生的灰浆和残渣制备化工原料KClO3和超细CaCO3 .
(2)Ⅰ.制备KClO3的流程如下: 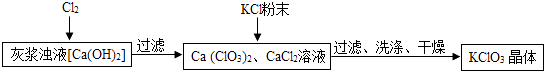
向灰浆浊液中通入Cl2 , 得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式 .
(3)有关物质在常温下的溶解度如下:
物质 | Ca(ClO3)2 | CalO3 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入KCl粉末,KCl与(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3晶体的原因是 .
(4)洗涤时,可选用下列洗涤剂(填字母编号). A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
(5)Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐): 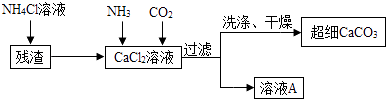
向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式 .
(6)流程中溶液A可循环使用,其主要成分的化学式是 .