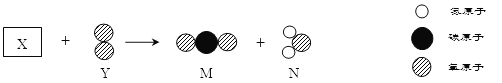【题目】现有铜和另一种金属的混合物8g,(可能是镁、铁、锌的一种)放入烧杯中,将140g14.0%的稀硫酸分四次加入到该烧杯中,每次充分反应后,测得剩余固体的质量的固体的质量数据如下:
次 数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/克 | 35 | 35 | 35 | 35 |
剩余固体质量/克 | 6.8 | 5.6 | 4.4 | 4.2 |
求:(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(精确到0.1%)
【题目】氢氧化钠是重要的工业原料,以下是有关它的性质实验。
①下图反应的化学反应方程式为 (24) ,反应后溶液(编号为a)中溶质的组成情况可能有 (25) 种。为证明溶液a中可能含有的溶质,进行了如下实验。

I.确定溶液a中是否含有氢氧化钠
步骤 | 现象 | 结论 |
取少量溶液a,滴加氯化铜溶液 | (26) | 不含氢氧化钠 |
II.确定溶液a中是否含有盐酸
方案 | 步骤 | 现象 |
一 | 取少量溶液a,滴加硝酸银溶液 | 产生白色沉淀 |
二 | 取少量溶液a,加入镁粉 | 产生气泡 |
i.上述方案中有一个设计不合理,指出不合理的实验方案编号及原因 (27) ;
ii.采取正确的实验方案,进行实验,根据现象得到的结论是 (28) ;
III.欲从溶液a中得到纯净的氯化钠,可以采取的实验操作是 (29) 。
②利用如下装置验证氢氧化钠能与二氧化碳反应。(装置气密性良好)
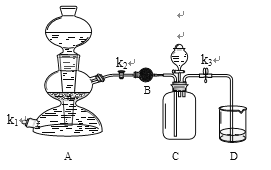
I.装置A用于制取二氧化碳,打开k2、k3,当D中紫色石蕊试液变(30)色,可确定C中收集满二氧化碳。
II.装置B中的药品是无水硫酸铜,用于干燥二氧化碳,写出该反应的化学反应方程式 (31) 。
III.C中收集满二氧化碳后,使A中反应暂停的操作是 (32) 。
IV.甲同学打开装置C中分液漏斗活塞,将8mL室温时氢氧化钠饱和溶液滴入C中,然后关闭活塞,观察到D中石蕊试液倒流至C中。甲同学得出结论,氢氧化钠能与二氧化碳反应。
V.乙同学认为上述现象不足以证明氢氧化钠能与二氧化碳发生反应,还应利用上述装置补充一个对比实验。
液体 | 步骤 | 现象 |
(33) | 打开分液漏斗活塞,加入液体后关闭活塞 | (34) |
结论:氢氧化钠能与二氧化碳反应,写出该反应的化学反应方程式 (35) 。