题目内容
【题目】氢氧化钠是重要的工业原料,以下是有关它的性质实验。
①下图反应的化学反应方程式为 (24) ,反应后溶液(编号为a)中溶质的组成情况可能有 (25) 种。为证明溶液a中可能含有的溶质,进行了如下实验。

I.确定溶液a中是否含有氢氧化钠
步骤 | 现象 | 结论 |
取少量溶液a,滴加氯化铜溶液 | (26) | 不含氢氧化钠 |
II.确定溶液a中是否含有盐酸
方案 | 步骤 | 现象 |
一 | 取少量溶液a,滴加硝酸银溶液 | 产生白色沉淀 |
二 | 取少量溶液a,加入镁粉 | 产生气泡 |
i.上述方案中有一个设计不合理,指出不合理的实验方案编号及原因 (27) ;
ii.采取正确的实验方案,进行实验,根据现象得到的结论是 (28) ;
III.欲从溶液a中得到纯净的氯化钠,可以采取的实验操作是 (29) 。
②利用如下装置验证氢氧化钠能与二氧化碳反应。(装置气密性良好)
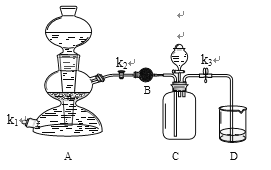
I.装置A用于制取二氧化碳,打开k2、k3,当D中紫色石蕊试液变(30)色,可确定C中收集满二氧化碳。
II.装置B中的药品是无水硫酸铜,用于干燥二氧化碳,写出该反应的化学反应方程式 (31) 。
III.C中收集满二氧化碳后,使A中反应暂停的操作是 (32) 。
IV.甲同学打开装置C中分液漏斗活塞,将8mL室温时氢氧化钠饱和溶液滴入C中,然后关闭活塞,观察到D中石蕊试液倒流至C中。甲同学得出结论,氢氧化钠能与二氧化碳反应。
V.乙同学认为上述现象不足以证明氢氧化钠能与二氧化碳发生反应,还应利用上述装置补充一个对比实验。
液体 | 步骤 | 现象 |
(33) | 打开分液漏斗活塞,加入液体后关闭活塞 | (34) |
结论:氢氧化钠能与二氧化碳反应,写出该反应的化学反应方程式 (35) 。
【答案】(24)NaOH+HCl=NaCl+H2O;(25)3;(26)溶液无蓝色絮状沉淀;(27)方案一不合理,生成的氯化钠也会和硝酸银生成白色沉淀;(28)溶液中溶质有NaCl和HCl;(29)蒸发结晶;(30)红; (31) CuSO4+5 H2O= CuSO4·5 H2O;(32)关闭K2;(33)水(或者蒸馏水);(34)D中导管先有气泡冒出,后D中导管中液面略上升稍高于杯内液面;(35 )2NaOH+CO2=Na2CO3+ H2O。
【解析】
试题分析:(24)略;(25)若恰好完全反应,那么就只有氯化钠,若氢氧化钠过多就是氯化钠和氢氧化钠,若盐酸过多就是氯化钠和盐酸,3种情况;(26)氢氧化钠会与氯化铜生成蓝色沉淀氢氧化铜,结论是不含氢氧化钠,那么当然也就不会有沉淀产生了;(27) 案一不合理,生成的氯化钠也会和硝酸银生成白色沉淀,就无法判定了;(28)肯定有NaCl,加入镁粉有气泡说明还有HCl;(29)通过蒸发就能将水除去,同时氯化氢气体也出逸走;(30)若装满,则就会有二氧化碳逸出进入D中,与水反应生成碳酸,能使石蕊变红;(31) CuSO4+5 H2O= CuSO4·5 H2O;(32)关闭K2,生成的气体无法排除,容器内气压增大将液体挤出,固体液体分离,没有接触就会停止反应;(33)二氧化碳也会溶于水且与水反应,因此必须设置对照试验;(34)水对二氧化碳的吸收能力和速度弱于氢氧化钠,因此水会将一部分气体挤出,后吸收一部分二氧化碳使气压弱于外界;(35 )2NaOH+CO2=Na2CO3+ H2O。

 阅读快车系列答案
阅读快车系列答案