题目内容
【题目】如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是
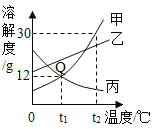
A.将丙的饱和溶液变为不饱和溶液,可采用升温的方法
B.t1 ℃时,可以制得溶质质量分数为8%的丙溶液
C.t2 ℃时,甲、乙两种物质的饱和溶液降温至0 ℃,析出甲的质量比析出乙的质量大
D.t1 ℃时,甲、乙、丙三种物质的饱和溶液升高到t2 ℃时,溶质质量分数为甲>乙>丙
【答案】B
【解析】
A、将丙的饱和溶液变为不饱和溶液,可采用升温的方法错误,应该是降温的方法,因为丙的溶解度随温度的升高而减少;故选项错误;
B、t1℃时,可以制得饱和的丙溶液的溶质质量分数=![]() ×100%≈10.7%,因此可以制得溶质质量分数为8%的丙溶液;故选项正确;
×100%≈10.7%,因此可以制得溶质质量分数为8%的丙溶液;故选项正确;
C、t2℃时,甲、乙两种物质的饱和溶液降温至0℃,析出甲的质量比析出乙的质量大错误,因为没有指明是等质量的饱和溶液;故选项错误;
D、t1℃时甲、乙、丙三种物质的饱和溶液升高到t2℃时,甲、乙溶解度变大,但溶质、溶剂质量均不变,溶质质量分数不变,t1℃乙的溶解度大于甲,故溶质质量分数乙大于甲,升温过程中丙的溶解度变小,有晶体析出,溶质质量分数变小,t1℃时甲的溶解度大于t2℃时丙的溶解度,因此溶质质量分数甲大于丙,故升温后溶质质量分数为乙>甲>丙;故选项错误。
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如右图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。

【进行猜想】猜想Ⅰ:该溶液的溶质是NaCl;
猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;
猜想IV:该溶液的溶质是NaHCO3.
【查阅资料】常温下物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3,因为常温下NaHCO3溶液溶质的质量分数最大是
(精确到01.%)。
【进行实验】
(1)测定溶液的pH大于7,该溶液的溶质不是 (填化学式)。
(2)同学们又进行了如下实验,实验过程如下:
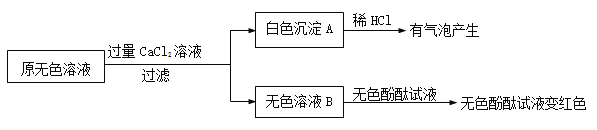
①产生白色沉淀的化学方程式是 。
②实验可以判断原无色溶液中含有的溶质有 。
【获得结论】
该瓶原来装的无色溶液的溶质是NaOH,并且 (填“没有”、“部分”或“全部”)变质。
【拓展】
提纯该无色溶液的步骤是:先向无色溶液中加入适量的 ,然后过滤。反应化学方程式是 。