题目内容
【题目】从宏观和微观的不同角度认识物质的变化和性质
(1)①气体X在氧气中燃烧生成氮气和水,X分子中一定含有的原子是(填符号).
②胃酸过多须服用抗酸药.下表为两种抗酸药的有效成分及其构成微粒:
抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
构成微粒 | Mg2+、OH﹣ | Al3+、Mg2+、OH﹣、CO32﹣ |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异. Mg(OH)2起抗酸作用的微粒是OH﹣ . 铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑.
则铝碳酸镁起抗酸作用的微粒是(填微粒符号).
(2)如图1所示 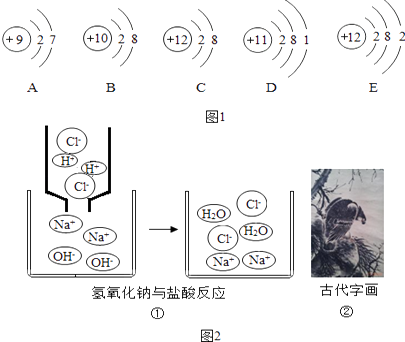
粒子A最外层电子数是 , 在化学反应中容易填“得”或“失”)电子;微粒A,B,C,D,E中,对应单质化学性质最稳定的是(填编号,下同),属于同一种元素的是D位于元素周期表中第周期.
(3)如图2所示
图①:从微观角度看,盐酸和氢氧化钠发生中和反应的实质是 .
写出与上述反应本质完全相同的另一个化学方程式 .
图②:古代字画能够保存很长时间不褪色的原因是 .
【答案】
(1)N,H;OH﹣,CO32﹣
(2)7;得;B;CE;三
(3)氢氧根离子和氢离子结合形成水分子;2HCl+Ca(OH)2═CaCl2+H2O;常温下碳的化学性质不活泼.
【解析】解:(1)根据质量守恒定律,化学反应前后原子的种类不变,反应后的原子种类是N、H、O,故X分子中一定含有的原子是N、H;(2)根据铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑,故AlMg(OH)3CO3中的
OH﹣、CO32﹣都能中和胃酸中的氢离子.(3)①由原子结构示意图可知,微粒A最外层电子数是7,大于4,在化学反应中容易电子;②微粒A、B、C、D、E中,B的原子的最外层电子数是8,达到了稳定结构,对应单质化学性质最稳定,C、E的质子数相同,属于同一种元素.根据图可知:D为钠元素,其原子有三个电子层,故位于元素周期表中第三周期.(4)根据反应可以知道,中和反应实质就是氢氧根离子和氢离子结合形成水分子的过程.根据题意,氢氧化钙与盐酸反应生成氯化钙和水,反应的化学方程式为:2HCl+Ca(OH)2═CaCl2+H2O.
因为墨的主要成分是碳,用墨汁书写或绘制的字画能够保存很长时间不变色,是因为常温下碳的化学性质不活泼.
所以答案是:(1)①N、H.②OH﹣、CO32﹣;(2)7,得,B,CE,三;(3)氢氧根离子和氢离子结合形成水分子;2HCl+Ca(OH)2═CaCl2+H2O;常温下碳的化学性质不活泼.
【考点精析】认真审题,首先需要了解中和反应及其应用(中和反应:酸与碱作用生成盐和水的反应),还要掌握质量守恒定律及其应用(①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏)的相关知识才是答题的关键.

 阅读快车系列答案
阅读快车系列答案