��Ŀ����
����Ŀ����ѧ�������ܲ��ɷ�
��1���������ʳ�ṹ���Ա������彡����ij��ʳƷ�����ϱ�ǩ��ͼ��ʾ��
�ٸ������и��������ʵ������� ��
�ڴ�Ӫ������ĽǶȿ�����ʳƷ�г�ˮ�⣬��ȱ�ٵ�Ӫ������ ��
��2�����õ���̬����������������������
���᳧����ˮ�к�����������ʣ����������кʹ��������ŷţ�
������ú���洫ͳú���Լ������ŷţ��Ӷ�����������γɣ�
��3��������ʹ�����Ľ�������
����������Ȼ����ȡ�����Ľ�����������¯������ԭ��������ʯ��������ʯ��ʯ�� �� д���ó�����Ϊԭ�������Ļ�ѧ��Ӧ����ʽ ��
�����Ļ�Ա���ǿ�����������г������ı���Ϳ�����ۣ���ԭ���� ��
�۽����ܣ�Co�������������ƵĻ�ѧ���ʣ�CoCl2��������ɫ�ģ�CoCl2��Һ�Ƿۺ�ɫ�ģ��ֽ�������Ͷ��ϡ�����У�������ѧ��ӦCo+2HCl�TCoCl2+H2�����÷�Ӧ��ʵ������Ϊ ��
�ܷϾɸ��������������������ȥ����ԭ���� �� 
���𰸡�
��1������������
��2���������ƣ���������
��3����̿��3CO+Fe2O3 ![]() 3CO2+2Fe�������������������ܵ���������Ĥ�����������ܽ⣬����������ݣ���Һ����ɫ��Ϊ�ۺ�ɫ��Fe2O3+6HCl=2FeCl3+3H2O
3CO2+2Fe�������������������ܵ���������Ĥ�����������ܽ⣬����������ݣ���Һ����ɫ��Ϊ�ۺ�ɫ��Fe2O3+6HCl=2FeCl3+3H2O
���������⣺��1�������и��������ʣ�С��ۡ���ɰ�Ǹ������ࡢʳ�θ������Ρ����������֬����ȱ��ˮ��ά���أ�����ټ�������ά���أ���2��������������һ�ּ�������к����Է�ˮ����ʹ������ú���Լ��ٶ�������������ŷţ��γ��������Ҫ�����Ƕ�����������������ƣ��ڶ�������3���ٸ�¯������ԭ��������ʯ��������ʯ��ʯ�ͽ�̿����¯����һ����̼��ԭ�����������Ļ�ѧ��Ӧ����ʽ��3CO+Fe2O33CO2+2Fe�������Ļ�Ա���ǿ�����������г������ı���Ϳ������������������ԭ���ǣ������������������ܵ���������Ĥ���۽�����Ͷ��ϡ������ʱ��������ѧ��Ӧ��Co+2HCl=CoCl2+H2�������ŷ�Ӧ�Ľ��У����������ܽ⣬����������ݣ���Һ����ɫ��Ϊ�ۺ�ɫ���������������ᷴӦ�����Ȼ�����ˮ�����Fe2O3+6HCl=2FeCl3+3H2O��
����ٽ�̿��3CO+Fe2O3 ![]() 3CO2+2Fe���������������������ܵ���������Ĥ���۽��������ܽ⣬����������ݣ���Һ����ɫ��Ϊ�ۺ�ɫ����Fe2O3+6HCl=2FeCl3+3H2O��
3CO2+2Fe���������������������ܵ���������Ĥ���۽��������ܽ⣬����������ݣ���Һ����ɫ��Ϊ�ۺ�ɫ����Fe2O3+6HCl=2FeCl3+3H2O��
�����㾫����������Ҫ�����˽������ϵ�ѡ�����ݺ�����ұ�������֪ʶ�㣬��Ҫ���պ�ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ���������������������ұ����ԭ�ϣ�����ʯ����̿��ʯ��ʯ������������������ʯ�д�������Ҫ�ɷ���Fe3O4 ������������Ҫ�ɷ���Fe2O3 ��������ȷ�����⣮

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�����Ŀ���Ӻ�ۺ��۵IJ�ͬ�Ƕ���ʶ���ʵı仯������
��1��������X��������ȼ�����ɵ�����ˮ��X������һ�����е�ԭ����������ţ���
��θ���������ÿ���ҩ���±�Ϊ���ֿ���ҩ����Ч�ɷּ��乹������
��θ��ҩ | ����������þƬ�� | ��̼��þƬ |
��Ч�ɷ� | Mg��OH��2 | AlMg��OH��3CO3 |
������ | Mg2+��OH�� | Al3+��Mg2+��OH����CO32�� |
���ڿ���ҩ��Ч�ɷֲ�ͬ���������ã�������θҺ�����ᣩ����Ҳ�в��죮 Mg��OH��2�������õ�����OH�� �� ��̼��þ������ķ�ӦΪ��AlMg��OH��3CO3+5HCl�TMgCl2+AlCl3+4H2O+CO2����
����̼��þ�������õ��������������ţ���
��2����ͼ1��ʾ 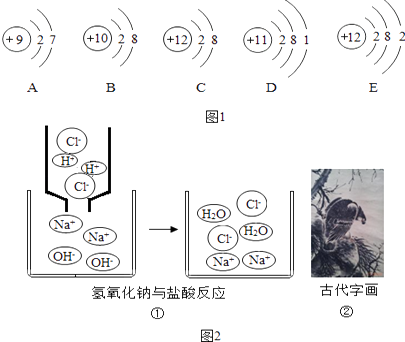
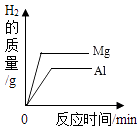
����A������������ �� �ڻ�ѧ��Ӧ��������á���ʧ�������ӣ���A��B��C��D��E�У���Ӧ���ʻ�ѧ�������ȶ����������ţ���ͬ��������ͬһ��Ԫ�ص���Dλ��Ԫ�����ڱ��е����ڣ�
��3����ͼ2��ʾ
ͼ�٣����۽Ƕȿ���������������Ʒ����кͷ�Ӧ��ʵ���� ��
д����������Ӧ������ȫ��ͬ����һ����ѧ����ʽ ��
ͼ�ڣ��Ŵ��ֻ��ܹ�����ܳ�ʱ�䲻��ɫ��ԭ���� ��