题目内容
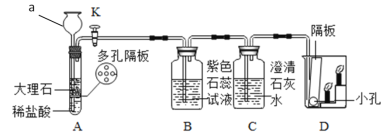
【题目】在学校学习有关酸、碱的化学性质后,马丁组织同学们用生活中的常见物品探究酸的性质。
(实验用品)醋精、食品干燥剂、鸡蛋壳、牵牛花花瓣、生锈铁钉、纯碱、pH试纸、木筷子。
(查阅资料)
①醋精中含有10%~15%的醋酸,呈无色。
②食品干燥剂的主要成分为氧化钙,鸡蛋壳的主要成分为碳酸钙。
③牵牛花汁液在酸性溶液中呈红色,中性溶液中呈紫色,碱性溶液中呈蓝色。
(实验方案)取等量醋精于烧杯中,分别进行如下操作:
实验1 | 实验2 | 实验3 | 实验4 | |
实验操作 |
|
|
|
|
实验现象 | 溶液变红 | 溶液变为浅黄色,一段时间后,有气泡产生 | 有气泡产生 | 有气泡产生 |
(解释与结论)
(1)实验1说明_______________。
(2)实验2中观察到有气泡产生的原因是____________。
(3)实验3可得到的结论是__________。
(4)实验4能否证明酸能与碱发生反应并说明原因是_________
(反思与评价)
(5)验证实验3和4生成气体是二氧化碳的实验是:_________。
(6)若向配制好的碱溶液中滴入牵牛花汁液,然后逐滴滴加醋精,边滴加边振荡,观察到_____,证明酸能与碱反应。
【答案】酸能使酸碱指示剂变色 醋酸与铁发生了反应 醋酸能与碳酸盐发生反应 不能,因为纯碱属于盐,不是碱,所以该实验只能证明酸能与碳酸盐发生反应 将反应生成的气体通入澄清石灰水中,观察到澄清石灰水变浑浊,故该气体是CO2 溶液由蓝色变为紫色(或红色)
【解析】
(1)因为醋精中含有醋酸,向醋精中滴加牵牛花汁液,观察到溶液由紫色变为红色,说明醋酸能使牵牛花汁液变红色,即酸能使酸碱指示剂变色;
(2)向醋精中放入生锈的铁钉,醋酸先与铁锈发生反应,所以观察到溶液逐渐由无色变浅黄色,当铁钉上的铁锈反应完全后,醋酸与铁钉发生反应,会观察到有气泡产生;
(3)实验3是将鸡蛋壳碎片加入到醋精中,鸡蛋壳的主要成分是碳酸钙,醋酸能与碳酸钙反应生成二氧化碳,证明醋酸能与碳酸盐发生反应;
(4)纯碱是碳酸钠的俗称,属于盐不属于碱,所以实验4不能证明醋酸能与碱发生反应;
(5)实验3是醋酸与碳酸钙反应、实验4是醋酸与碳酸钠反应,两者都有气体生成,若要验证该气体是二氧化碳,故可以将生成的气体通入澄清石灰水中,若观察到澄清石灰水变浑浊,说明该气体是二氧化碳;
(6)醋精中含有醋酸,将醋精加入滴有牵牛花汁液的碱溶液中,若观察到溶液由蓝色变为紫色(或红色),证明酸和碱发生了反应。

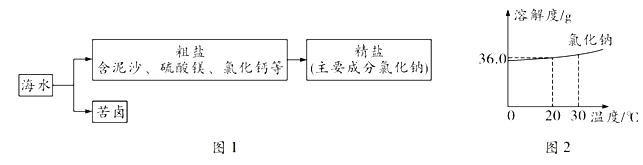
【题目】阅读下面科普短文。
随着国内轿车工业的迅急发展,人们每天坐在汽车里的时间越来越长,而车内的空气质量状况也成为影响健康的重要因素之一。
下图为中国科学院所属理化环境分析研究中心发布的《国内汽车空气质量报告》中的测试结果(选取使用年限不同的50款市场上常见的车型进行检测)。

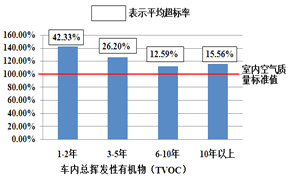
这份空气质量报告,无疑为我们敲响了警钟。
车内空气污染到底来源于哪里?下表列举了车内空气污染的源头及主要污染物。
主要源头 | 主要污染物 |
源头一:车内配件、材料和装饰物 车内本身的各种配件和材料释放的有害气体;买车后进行装饰,装饰物释放的有害气体。 | 总挥发性有机物( TVOC),包括:甲醛(CH2O)、苯(C6H6)等 |
源头二:空调系统、死角腐物 空调系统内潮湿阴暗的角落,成为霉菌大量繁殖的温床;车厢角落遗落的食品容易腐烂发霉。 | 胺、烟碱、霉菌及繁殖产生的霉味气体等 |
源头三:发动机长时间运转 汽车发动机长时间运转产生的热量会增加车内污染物的挥发,发动机运转中也会产生有害物质。 | CO、汽油挥发成分、胺、烟碱等 |
如何改善车内空气质量呢?下面是一些常见的做法。
① 开窗通风:通常情况下,开窗通风是改善车内空气质量最有效的方法。
② 臭氧消毒:通过臭氧的氧化性可以去除一部分有害气体。
③ 安装车载空气净化器:某品牌空气净化器的工作原理如下图所示,空气通过HEPA过滤材料,清理空气中的尘埃及细小颗粒物,再通过活性炭的协同作用,吸附异味;甲醛在蜂窝状高效催化剂的作用下和氧气反应转化为二氧化碳和水,具有不产生二次污染的优点。
![]()
为满足人们对健康生活的追求,提高人们的生活品质,一些新技术、新材料也会不断地优化和使用。
依据文章内容,回答下列问题。
(1)车载空气净化器工作原理图中活性炭主要起过滤和________作用。
(2) 《国内汽车空气质量报告》中的测试结果给我们敲响了警钟,其原因是________。
(3)甲醛在蜂窝状高效催化剂的作用下发生反应的化学方程式为_______。
(4)下列有关说法中,正确的是_______(填序号)。
A.车内的配件和装饰是车内主要污染源之一
B.车辆越新,TVOC超标越严重
C.臭氧消毒是利用臭氧的物理性质
(5)请你写出一条保持车内空气清洁的方法________。
【题目】电石是一种重要的化工原料。同学们借助网络资源和化学实验对电石的性质和变化进行如下的科学探究,请你也参与其中。
(查阅资料)
①电石的主要成分为碳化钙(化学式为CaC2),碳化钙与水反应生成一种白色固体和一种可燃性气体。
②将紫甘蓝汁液分别滴入下列液体中,显示的颜色如下表:
液体名称 | 白醋 | 食盐溶液 | 肥皂水 | 纯碱溶液 |
紫甘蓝汁液显示的颜色 | 红色 | 蓝紫色 | 蓝色 | 绿色 |
(作出猜想)根据碳化钙及水的组成推测:①碳化钙与水反应生成的白色固体可能是___________(写出两种物质)。
②碳化钙与水反应生成的可燃性气体可能是H2、CH4或C2H2(乙炔)。
(实验探究)同学们在老师的指导下,按如下步骤进行实验:
(1)取适量的电石加水,剧烈反应,放出大量的热,产生无色气体。
(2)收集反应生成的气体,验纯后点燃,发现气体燃烧时产生黄色火焰并伴有浓烈黑烟,因此该气体不可能是_____________。
(3)分别取反应生成的白色固体于两支试管中,进行如下的操作:
实验操作 | 实验现象 | 实验结论 |
①向一支试管中滴加足量的稀盐酸 | 固体溶解,但无气体产生 | 白色固体是________ |
②向另一支试管中加入适量的水,振荡、静置,再向上层清液中滴加_________ | 溶液变为绿色 |
(实验结论)碳化钙与水反应的化学方程式为___________。
(问题交流)
(1)存放电石的库房若发生火灾,___________(填“能”或“不能”)用水扑救。
(2)乙炔(C2H2)含碳量极高,它在空气中燃烧会冒出浓厚的黑烟(炭黑)。要使乙炔气体充分燃烧,常采用的方法是_____________。