题目内容
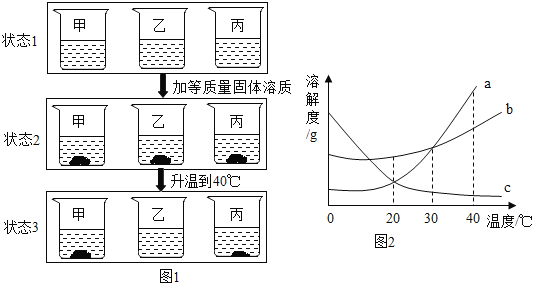
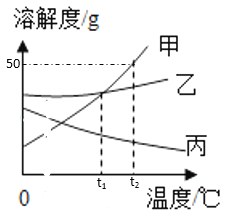
【题目】天津是美丽的海滨城市,依山傍水,海洋资源和石灰石资源丰富。图1是从海水制备精盐的流程图,图2是氯化钠的溶解度曲线。回答问题:
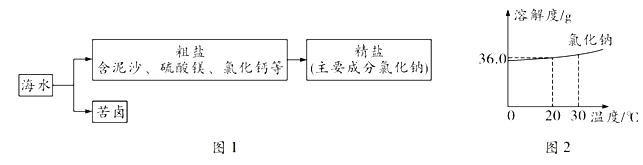
(1)海水可经过_________________________(填“冷却结晶”或“蒸发结晶”)的方法可获得粗盐,主要原因是_________________________。
(2)某同学在实验室里进行将粗盐中杂质去除的实验。
①除去上述粗盐中的可溶性杂质,正确的操作顺序是_________________________。
A.加过量Na2CO3溶液
B.加过量Ba(OH)2溶液
C.加适量盐酸
D.过滤
②过滤所用的玻璃仪器有:烧杯、漏斗和_________________________。
③在本实验中,先称取5g粗盐,再量取10mL水,加粗盐至不再溶解为止时称得剩余粗盐质量为1g,通过以上实验过程最终得到3.5 g精盐,则精盐的产率是_________________________。
(3)工业上从晒盐后的卤水中提取重要金属镁。提取镁的步骤如图所示:
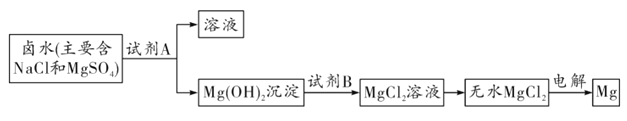
①试剂B选用_________________________(填名称);
②在最后一步发生的反应中除了得到金属镁以外,还生成了另一种单质。该反应的化学方程式为_________________________。
【答案】蒸发结晶 氯化 钠的溶解度随温度的改变变化不明显(或氯化钠的溶解度受温度变化的影响较小) BADC 玻璃棒 87.5% 稀盐酸 
【解析】
(1)冷却结晶适合从溶液中获得随温度升高溶解度增大且变化明显的物质。蒸发结晶适合从溶液中获得如氯化钠这样溶解度受温度影响变化不明显的物质。
(2)①本题的除杂方案没有第二种。A和B的试剂过量的部分应确保在后面的操作中能够被除去,所以A必须在B的后面,C必须在A的后面,而D过滤一定要在产生沉淀之后,加入盐酸之前。本题如果A在B的前面,最终所得氯化钠中将含有氯化钡,故填:BADC;
②过滤所用的玻璃仪器有烧杯、漏斗和玻璃棒;③精盐的产率为![]() 。
。
(3)①氢氧化镁是不溶于水的碱,跟盐溶液不反应,只能通过加入稀盐酸反应生成氯化镁;
②从氯化镁的组成元素上看,生成两种单质,只能是镁和氯气,可参考电解水的化学方程式,反应物中没有气体,生成的氯气应标注气体符号 。
。

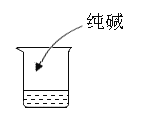
【题目】在学校学习有关酸、碱的化学性质后,马丁组织同学们用生活中的常见物品探究酸的性质。
(实验用品)醋精、食品干燥剂、鸡蛋壳、牵牛花花瓣、生锈铁钉、纯碱、pH试纸、木筷子。
(查阅资料)
①醋精中含有10%~15%的醋酸,呈无色。
②食品干燥剂的主要成分为氧化钙,鸡蛋壳的主要成分为碳酸钙。
③牵牛花汁液在酸性溶液中呈红色,中性溶液中呈紫色,碱性溶液中呈蓝色。
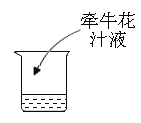
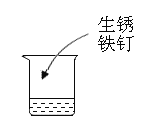
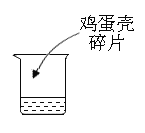
(实验方案)取等量醋精于烧杯中,分别进行如下操作:
实验1 | 实验2 | 实验3 | 实验4 | |
实验操作 |
|
|
|
|
实验现象 | 溶液变红 | 溶液变为浅黄色,一段时间后,有气泡产生 | 有气泡产生 | 有气泡产生 |
(解释与结论)
(1)实验1说明_______________。
(2)实验2中观察到有气泡产生的原因是____________。
(3)实验3可得到的结论是__________。
(4)实验4能否证明酸能与碱发生反应并说明原因是_________
(反思与评价)
(5)验证实验3和4生成气体是二氧化碳的实验是:_________。
(6)若向配制好的碱溶液中滴入牵牛花汁液,然后逐滴滴加醋精,边滴加边振荡,观察到_____,证明酸能与碱反应。