题目内容
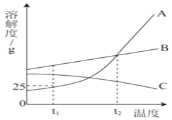
【题目】向盛有28g氯化钡和氯化钠固体混合物的烧杯中加入273.3g水,固体完全溶解。再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。请计算:
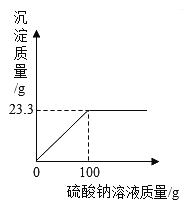
(1)反应过程中生成沉淀的质量__________g;
(2)固体混合物中氯化钡的质量_____;
(3)恰好完全反应时,所得溶液中溶质的质量分数。_____
【答案】23.3 20.8g 5%
【解析】
(1)由题意可知反应生成沉淀的质量为23.3g,故填23.3;
(2)已知生成沉淀质量,根据化学方程式求其它反应物或生成物质量,
解:设固体混合物中氯化钡的质量为x,生成氯化钠的质量为y,
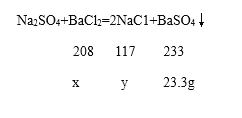
![]() =
=![]()
![]() =
=![]()
x=20.8g
y=11.7g
则固体混合物中氯化钡的质量故填20.8g;
(3)由上计算可知,恰好完全反应时,生成氯化钠的质量为11.7g,又知原混合物中氯化钠为28g-20.8g=7.2g,则溶液中总氯化钠的质量为:11.7g+7.2g=18.9g,根据质量守恒可知所得溶液的质量为28g+100g+273.3g-23.3g=378g,则所得溶液中溶质的质量分数为![]() ×100%=5%,故填5%。
×100%=5%,故填5%。

【题目】宏宏同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,宏宏邀约几个喜欢探究的同学对此进行了探究。请你一起完成下列实验报告。
(1)(提出问题1)
该溶液是否变质?
(实验探究1)
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有_____产生 | 说明该溶液已变质。变质的原因是_____(请用化学方程式表示)。 |
(2)(提出问题2)
该溶液变质程度怎样?
(提出猜想)
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有_____。
(查阅资料)
氯化钡溶液呈中性。
(实验探究2)
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有_____生成 | 猜想_____成立 |
静置,取上层清液于另一支试管中,加入2﹣3滴酚酞溶液 | 上层清液变红 |
(3)(提出问题3)
怎样提纯该样品得到纯净的氢氧化钠固体。
(实验探究3)
为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。
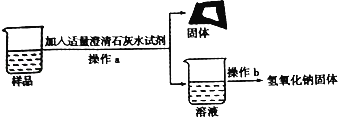
请回答下列问题:
①操作a和操作b中都需用到玻璃棒,其中操作a中玻璃棒的作用为_____。
②根据实验流程可知,最终所得氢氧化钠固体质量_____变质后样品中氢氧化钠的质量(填“大于”、“小于”或“等于”)。
(4)(反思交流)
在(实验探究2)中加入过量的氯化钡溶液的目的是什么?_____。