题目内容
(5分)某石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4 g石灰石样品,把20 g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
| 次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 稀盐酸的用量 | 5 g | 5 g | 5g | 5g |
| 剩余固体的质量 | 3 g | 2 g | 1 g | 1 g |
(2)列出4 g石灰石完全反应生成的二氧化碳质量(x)的比例式_________________;
(3)该稀盐酸的溶质质量分数为___________;
(4)向第二次反应结束后的溶液中加入8.88 g水,所得不饱和溶液的溶质质量分数为___________;
(5)若要配制20 g上述稀盐酸需要36.5%的浓盐酸和水的质量比为________________。
(1)CaCO3+2HCl===CaCl2+H2O+CO2↑(2)100/44=3g/X(3)14.6%(4)11.1%(5)2:3
解析试题分析:(1)碳酸钙与稀盐酸反应的方程式为:CaCO3+2HCl===CaCl2+H2O+CO2↑;
(2)根据在化学反应中各物质质量成比例,碳酸钙与二氧化碳的质量比为100:44,可得4g石灰石完全反应生成的二氧化碳质量为X,比例式为100/44=3g/X;
(3)设5g稀盐酸中溶质的质量为X
CaCO3+2HCl===CaCl2+H2O+CO2↑
73
1g x
100:73=1g:X解得X=0.73g
所以盐酸溶液的溶质质量分数为:0.73g/5g*100%=14.6%
(5)根据溶液稀释前后溶质的质量不变可得:20g*14.6%=m*36.5%,解得m="8" 则需加水的质量为20g-8g=12g,即需要36.5%的浓盐酸和水的质量比8g:12g=2:3。
考点:有关化学方程式的计算

 一本好题口算题卡系列答案
一本好题口算题卡系列答案(7分) 小明将14.4g含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与90g稀盐酸相混合,恰好完全反应,测得反应生成气体的质量(m)与反应时间(t)的数据如下表所示:
| 反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 | t 7 |
| 气体质量m/g | 0 | 0.88 | 1.76 | 2.64 | 3.52 | 4.4 | X | 4.4 |
计算样品中NaCl的质量;
计算完全反应后所得溶液中溶质的质量分数
CO2和CO的混合气体3.6g与足量灼热的氧化铁充分反应后,将生成的气体全部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液的质量为84.4克,则原混合气体中CO质量为( )
| A.4.4g | B.2.8g | C. 1.4g | D.0.8g |
(9分)医用二水合氯化钙可用于补钙、抗过敏和消炎等,以某碳酸钙样品(其中含少量Al3+、Fe3+等杂质)生产医用二水合氯化钙的工艺流程为: (已知二水合氯化钙在温度超过160°C时分解为氯化钙和水)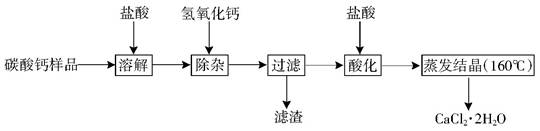
已知:查阅资料得知氢氧化物沉淀及溶解时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(2)除杂操作是加入稍过量的氢氧化钙,调节溶液的pH使Al3+、Fe3+全部转化为沉淀,此时应该控制溶液的的pH(X)范围是 ;滤渣A的主要成分的化学式为 。
(3)酸化时加盐酸的主要目的为了 。
(4)蒸发结晶时,必须控制温度低于160℃的原因是 。
(5)若所用碳酸钙样品12.5Kg,最后所得的产物中含氯化钙11.1Kg,则样品中碳酸钙的质量分数最大为多少 ?(写出计算过程,3分)
某兴趣小组同学在一次实验中偶然发现:向盛有一定量铁粉的烧杯中加入稀硫酸有气泡产生,迅速加入一定量的氧化铜,搅拌,不再产生气泡、黑色粉末中逐渐出现红色固体后又有气泡产生。请回答:
① 若实验过程中共收集到0.1 g氢气,求生成0.1 g氢气所消耗的硫酸的物质的量。
② 加入氧化铜后,不产生气泡的原因是 (11) (用化学方程式表示)。
③ 充分反应后过滤,为确定滤液中的溶质成分,在滤液样品中插入一根铁丝,可能出现的现象和结论如下。
| 现象 | 结论 |
| (12) | 滤液中的溶质是FeSO4 |
| 有红色固体析出 | 滤液中的溶质可能有哪几种情况? (13) |
| (14) | 滤液中的溶质是 (15) |