题目内容
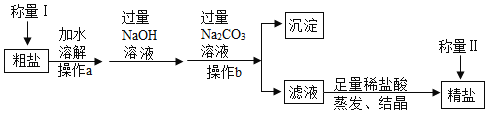
【题目】小苏打和食盐是厨房中常用物质。现有一包白色固体,可能由 NaHCO3 和 NaCl 中的一种或两种组成。某科学小组同学展开了系列拓展性研究。
(一)定性
(实验目的)确定白色固体的组成
(实验方案)

(实验结论)该白色固体由_____组成;
(1)实验步骤①中选用稀硝酸而不用稀盐酸的原因是_____;
(2)实验步骤②中生成白色沉淀的化学反应方程式为_____。
(二)定量分析
(实验目的)测定该白色固体中 NaHCO3 的质量分数
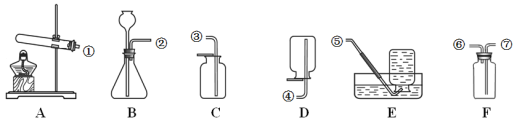
(实验方案)用气体法测定样品中 NaHCO3 的质量分数。实验装置如下:
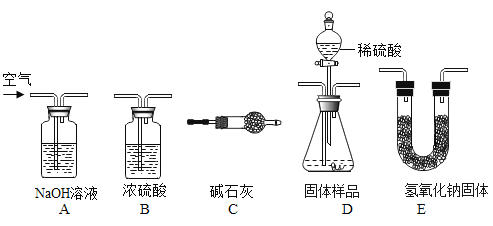
(1)用上述装置完成本实验,装置的连接顺序是 A→_____→_____→_____→C(填装置的字母编号,不重复使用);
(2)D 装置中发生反应的化学方程式为_____;
(3)如果没有经过 A 装置而直接通入空气,会使测量结果_____(填“变大”、“变小”或“不变”);
(4)C 装置的作用是_____;
(5)D 装置中的反应完全后,称量前,还需要进行的实验操作是_____。
【答案】NaHCO3 和 NaCl 防止带入氯离子,对氯化钠的检验造成干扰 CO2+Ca(OH)2=CaCO3↓+H2O D B E 2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O 变大 防止空气中的二氧化碳和水蒸气进入装置造成实验误差 A 装置中继续通入空气
【解析】
(一)定性
实验结论:样品与过量的硝酸反应生成气体,气体能与澄清石灰水产生白色沉淀,说明样品中存在碳酸氢钠;
样品与过量硝酸反应生成溶液中加入硝酸银溶液,产生白色沉淀,氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,说明样品中存在氯化钠。该白色固体由NaHCO3 和 NaCl组成;
(1)实验步骤④中选用稀硝酸而不用稀盐酸的原因是稀盐酸中含有氯离子,影响对氯化钠的检验;
(2)实验步骤②中生成白色沉淀,是因为氢氧化钙与二氧化碳反应生成碳酸钙和水,反应的化学反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(二)定量分析
(1)用上述装置完成本实验,装置的连接顺序是A(除去空气中二氧化碳)→D(反应生成二氧化碳)→B(吸收水蒸气)→E(吸收二氧化碳)→C(防止二氧化碳和水蒸气进入E装置)故填:D→B→E;
(2)D装置中碳酸氢钠和稀硫酸反应生成硫酸钠、水和二氧化碳,发生反应的化学方程式为:2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O;
(3)如果没有经过A装置而直接通入空气,会导致测定的二氧化碳质量判断,从而使测量结果变大;
(4)C装置的作用是防止空气中的二氧化碳和水蒸气进入装置造成实验误差;
(5)D装置中的反应完全后,称量前,还需要进行的实验操作是继续通入空气,使反应生成的二氧化碳全部被氢氧化钠吸收。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某校化学兴趣小组在查阅资料时发现:可燃物燃烧需要的最低氧含量数据如下表。
可燃物名称 | 蜡烛 | 木炭 | 棉花 | 红磷 | 白磷 |
最低氧含量/% | 16 | 14 | 8 | 8.8 | 3.2 |
请结合数据回答下列问题:
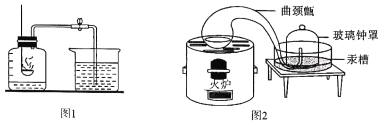
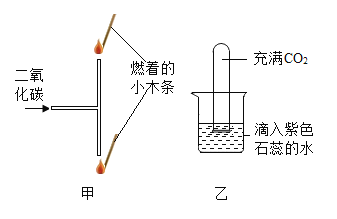
(1)图1为教材中测量空气中氧气体积分数的实验装置图,请写出集气瓶中发生的化学反应程式:___________。结合数据,你认为红磷适合于测量空气中氧气的体积分数吗?并说明你的理由:_________。但实验过程中又确实看到进来的水的体积约占集气瓶内容积的1/5,其原因可能是________。
(2)图2是拉瓦锡的实验装置,回看拉瓦锡的实验,选择汞的优点有_________(填序号,多选)。
A 实验过程没有污染
B 生成的化合物加热分解后又得到汞和氧气
C 在汞槽中起到液封作用
D 能将密闭装置内空气中的氧气几乎耗尽