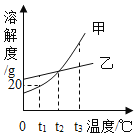
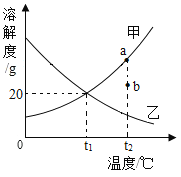
题目内容
【题目】I.某兴趣小组在实验室模拟水厂将塘河水净化成自来水,并最终制成蒸馏水,其流程如下图所示:
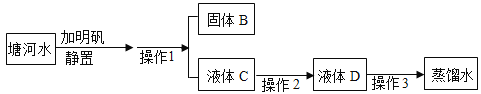
请回答下列问题:
(1)高铁酸钠(Na2FeO4)也可净水,高铁酸钠中铁元素的化合价为_____。
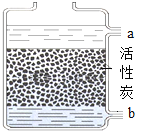
(2)利用如图所示的装置进行操作2,此操作的作用是_____; 待处理的水应该从_____,端通入 (填“a”或“b”),使水处理更充分。
(3)取少量液体D于试管中,滴入肥皂水振荡,发现有较多的浮渣产生,说明此液体为_____ (填“软水”或“硬水”), 生活中常用_____的方法软化硬水。
(4)通过操作3可以得到净化程度较高的蒸馏水,操作3的名称是_____。
II.用水厂炉渣(主要含FeO、Fe2O3, 还有少量既不溶于水也不溶于酸的杂质)制备绿矾(FeSO4﹒7H2O)的工艺流程如下:
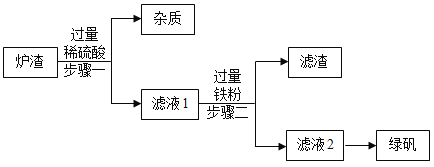
查阅资料:铁与硫酸铁反应生成硫酸亚铁。
(1)步骤一中,发生的反应之一为FeO+H2SO4= FeSO4+H2O, 其基本反应类型为_____。
(2)测得滤液2的pH明显大于滤液1,其原因是_____。
【答案】+6 除去色素和异味 b 硬水 煮沸 蒸馏 复分解反应 铁消耗过量的硫酸,溶液的酸性变弱,pH增大
【解析】
I.(1)根据化学式和一些元素的化合价,求其他元素的化合价。
(2)根据吸附的特点、净水器的特征进行分析解答。
(3)根据硬水和软水的特点、生活中硬水软化的方法进行分析解答。
(4)根据能得到蒸馏水的操作进行分析解答。
II.(1)根据化学反应的类型的定义进行分析解答。
(2)测得滤液2的pH明显大于滤液1,其原因是:铁粉与过量的硫酸反应。
(1)在Na2FeO4中,Na显+1,O显﹣2,设Fe的化合价为x,(+1)×2+x+(﹣2)×4=0 x=+6;故填:+6。
(2)操作2是吸附,为了除去色素和异味;待处理的水应该从b端通入,因为这样的净化效果更好;故填:除去色素和异味;b。
(3)取少量的液体D于试管中,滴入肥皂水振荡,发现有较多的浮渣产生,说明此液体为硬水,生活中常用煮沸的方法软化硬水;故填:硬水;煮沸。
(4)通过操作3可以得到净化程度较高的蒸馏水,操作3是蒸馏。故填:蒸馏。
II(1)复分解反应是两种化合物互相交换成分生成另外两种化合物的反应,步骤一中,FeO+H2SO4=FeSO4+H2O属于复分解反应;故填:复分解反应。
(2)测得滤液2的pH明显大于滤液1,其原因是:滤液1中硫酸过量,滤液2中铁粉与过量的硫酸反应,氢离子反应了,溶液的酸性变弱,因此pH大了;故填:铁消耗过量的硫酸,溶液的酸性变弱,pH增大。

【题目】“克罗米”技术是指在眼镜的金属镜架、自行车车把与钢圈等金属表面镀上一层金属铬(Cr)。小明发现在常见金属活动性顺序中没有铬,于是他和小组同学一起探究铬与常见金属镁和铜的活动性强弱。
(查阅资料)铬(Cr) 是一种银白色金属,在空气中能形成一层致密的氧化膜,可阻止铬进一步被氧化;硫酸亚铬(CrSO4) 溶液呈蓝色,硫酸亚铬中铬元素的化合价为__。
(提出猜想)三种金属的活动性强弱为:
①Cr> Mg>Cu ②Mg>Cu>Cr ③____
[实验探究]
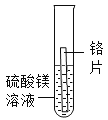
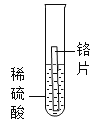
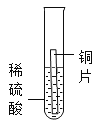
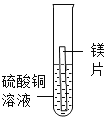
实验1 | 实验2 | 实验3 | 实验4 | |
实验方案 |
|
|
|
|
现象 | 无明显现象 | 铬片上有气泡产生,溶液逐渐变成蓝色 | 无明显现象 | ___ |
结论 | 猜想___正确 | |||
(交流与讨论)
(1)实验前所用的金属片都需用砂纸打磨,其目的是__。
(2)实验4中反应的化学方程式为___。
(3)结合探究结论,有同学提出四个实验可进行优化,只需选择三种药品,即可金属的活动性强弱。合理的选择是_____。
①硫酸镁溶液②硫酸亚铬溶液③硫酸铜溶液④稀硫酸⑤镁片⑥铬片⑦铜片