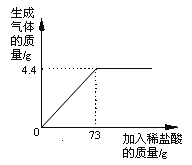
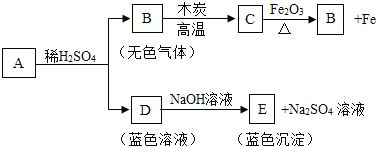
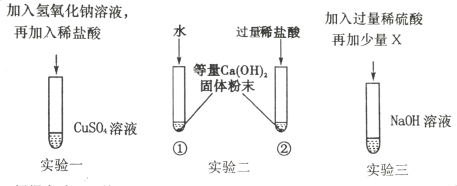
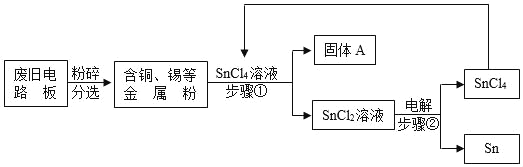
��Ŀ����
����Ŀ���������������������й㷺����;��
��1���ִ����ʹ�ô����ĸ�������Ҫ����һ����̼������ʯ�н�����ԭ�����ģ���д����һ����̼�Ӵ������л�ԭ�����Ļ�ѧ��Ӧ����ʽ__________��
��2��������Ʒʹ�ò��������⣬��ϡ�������ϴ��������������⣨��Ҫ�ɷ���Fe2O3�����仯ѧ����ʽΪ___����д�������з�ֹ�������һ�־�������______��
��3�����Ļ�ѧ���ʱ������ã�������Ʒȴ��ʴ����ԭ���û�ѧ��Ӧ����ʽ��ʾΪ____
��4�����շϾɽ����ĺô���________�����һ�㼴�ɣ���
���𰸡�4CO+Fe3O4![]() 3Fe+4CO2 Fe2O3+6HCl==2FeCl3+3H2O ������Ʒ����ˢ���� 4Al+3O2==2Al2O3 ��Լ������Դ��
3Fe+4CO2 Fe2O3+6HCl==2FeCl3+3H2O ������Ʒ����ˢ���� 4Al+3O2==2Al2O3 ��Լ������Դ��
��������
��1����������Ҫ�ɷ���������������һ����̼��������������Ӧ�������Ͷ�����̼����Ӧ�Ļ�ѧ��Ӧ����ʽ��4CO+Fe3O4![]() 3Fe+4CO2��
3Fe+4CO2��
��2���������Ҫ�ɷ���Fe2O3����ϡ���ᷴӦ�����Ȼ�����ˮ����Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+6HCl==2FeCl3+3H2O��������������������ˮ��ͬ���õĽ����������Ʒ����ˢ������һ�����������ɷ�ֹ�����⡣
��3�������£���������е�������Ӧ����һ�����ܵ���������Ĥ������ֹ����һ����������Ӧ�Ļ�ѧ��Ӧ����ʽΪ��4Al+3O2==2Al2O3
��4�����շϾɽ����ĺô��ǿɽ�Լ������Դ��

 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
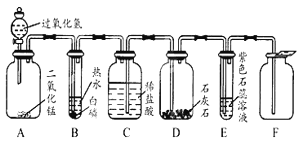
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�����Ŀ��ij��ѧʵ��С���ͬѧ������ͼ��ʾװ�ý���ʵ��:
(1)A�з�Ӧ�Ļ�ѧ����ʽΪ_______________
(2)A�з�Ӧ��ʼʱ�����ɼ�C���ڴ�״̬��B �з�Ӧ�Ļ�ѧ����ʽΪ___________________
(3)һ��ʱ���,�ر� C,װ�� A �����ڷ�Ӧ����һ������۲쵽װ�� B�г��ְ�ɫ����,�ó����Ļ�ѧʽΪ________________��
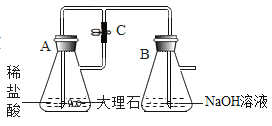
(4)С��ͬѧ̽����Ӧ��װ�� B �е���Һ�����ʳɷ֡�
��������⣩��Ӧ��װ�� B ����Һ�����ʳɷ���ʲô?
����������裩���� 1:NaCl��HCl ���� 2: NaCl��CaCl2
���� 3:NaCl��NaOH ���� 4:NaCl��NaOH��Na2CO3
���������ۣ������ۣ����һ����Ϊ����_______________һ���������������� ______________��
��ʵ��̽��������Ӧ��װ�� B �����û�������ȡ������Һ�ֱ��������ʵ��: ʵ�� 1:����Һ�еμ�̼������Һ���������������_______________����ȷ��
ʵ�� 2:����ݱ���������д��
ʵ���ṩ��ҩƷ��:��̪��Һ��ϡ���ᡢBa��OH)2,��Һ BaC12 ��Һ��
ʵ����� | ������Һ�м������_______________ | ������Һ�еμӷ�̪��Һ |
ʵ������ | _______________ | ______________ |
ʵ����� | ���� 4 ��ȷ | |
����˼���ۣ�ʵ�������ͬѧ�Ǿ������������ۺ���Ϊ:̽����Ӧ��������Һ�����ʳɷ�ʱ,����Ҫ����������,��Ҫ���Ƿ�Ӧ���Ƿ������