题目内容
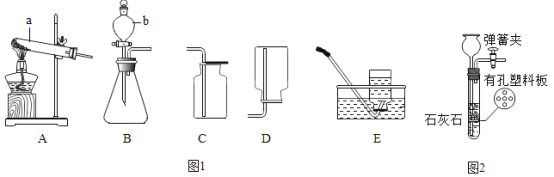
【题目】如图所示的三个实验均可验证酸与碱能反应:
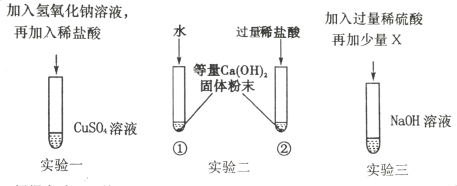
(1)根据实验一回答:该实验通过____的现象,验证了酸与碱能发生反应。
(2)实验二通过两支试管中的现象对比,可以判断稀盐酸与氢氧化钙能反应,除需控制温度外,还需控制_____________ 、______________相同。
(3)实验三中,加入X可验证稀硫酸与碱能发生反应,写出三种不同类别的符合此条件的X_______
(4)实验二结束后,某同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,与试管②中反应后溶液混合,静置后向上层清液滴入酚酞:上层为无色溶液,底部有白色沉淀。设计实验方案,探究上层清液中的溶质成分,写出实验操作、预期现象和结论_______。
【答案】蓝色沉淀消失 水和稀盐酸的体积 氢氧化钙粉末的质量 酚酞、氧化铜、硫酸铜 取样于试管中,滴入碳酸钠溶液,有白色沉淀产生,则溶质为氯化钠、氯化钙;
无白色沉淀,溶液变红,溶质为氯化钠
【解析】
(1)实验一中,2NaOH +CuSO4 =Cu(OH)2↓+Na2SO4,产生蓝色氢氧化铜沉淀,加入稀盐酸后蓝色沉淀消失,验证了酸与碱能发生反应。
(2)做对比实验,必须控制变量,当只有一个条件不同时,才可探究出该条件是否对实验有影响,故实验二通过两支试管中的现象对比,可以判断稀盐酸与氢氧化钙能反应,除需控制温度外,还需控制水和稀盐酸的体积相同、氢氧化钙粉末的质量相同。
(3)酚酞遇碱性溶液变红,遇中性或酸性溶液不变色,向氢氧化钠溶液中加入过量稀硫酸,再滴加酚酞试液,酚酞试液不变色,说明溶液不是碱性,即氢氧化钠与稀硫酸发生了反应;向氢氧化钠溶液中加入过量稀硫酸,再加入氧化铜,CuO+H2SO4=CuSO4+H2O,CuSO4能与NaOH溶液反应产生蓝色沉淀,无蓝色沉淀生成,说明氢氧化钠与稀硫酸发生了反应;向氢氧化钠溶液中加入过量稀硫酸,再加入硫酸铜溶液,无蓝色沉淀生成,说明氢氧化钠与稀硫酸发生了反应。
(4)试管②中含有生成的CaCl2、过量的稀盐酸。实验二结束后,某同学将碳酸钠溶液加入氢氧化钙溶液中,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,与试管②中反应后溶液混合,发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,NaOH+HCl=NaCl+H2O,静置后向上层清液滴入酚酞:上层为无色溶液,说明反应后的溶液呈中性或酸性,即稀盐酸恰好反应或过量,底部有白色沉淀,则沉淀是CaCO3,故上层清液中不含有稀盐酸,溶质成分是:氯化钠、氯化钙。取样于试管中,滴入碳酸钠溶液,如果有白色沉淀产生,则溶质为氯化钠、氯化钙;无白色沉淀,溶液变红,则溶质为氯化钠。

 名校课堂系列答案
名校课堂系列答案【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
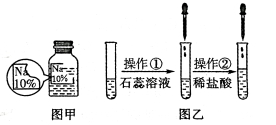
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。