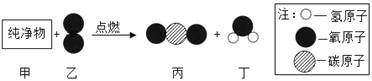
题目内容
【题目】图中A、B、 C、 D是四种粒子的结构示意图,E是银元素在周期表中的信息,请回答下列问题:
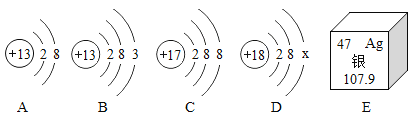
(1)图中A、B、C、 D四种粒子共表示_____种元素。
(2)A. B. C. D中表示的阳离子符号为_____。
(3)D中X=_____。 E中银元素的质子数为_____,一个银原子质量是一个C-12原子质量的_____倍。
【答案】三 Al3+ 8 47 9
【解析】
(1)依据质子数不同元素种类不同,由图示可知四种微粒中共有质子数是13、17和18的三种元素:
(2)A、B、C、D中表示的阳离子是A,核内质子数是13,表示铝元素,失去3个电子后形成带3个单位正电荷的铝离子,可以表示为Al3+;
(3)由于原子中,质子数与核外电子数相等,观察可知该微粒的质子数是18,是具有稳定结构的氩原子,所以核外电子数也应为18,所以X为8;元素周期表中的一格可以获得的信息:左上角的数字表示原子序数;在原子中原子序数=质子数, E中银元素原子的质子数为47;元素周期表中的一格可以获得的信息,汉字下面的数字表示相对原子质量,银的相对原子质量约为108。由于相对原子质量之比等于其质量之比,所以一个银原子质量是一个碳12原子质量的![]() 。
。

 字词句段篇系列答案
字词句段篇系列答案【题目】下列实验设计不能达到实验目的的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 探究二氧化锰能否加快过氧化氢分解 | 探究石蜡燃烧后是否有二氧化碳生成 | 检验氧气是否集满 | 测定空气中氧气的含量 |
A. A B. B C. C D. D
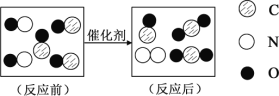
【题目】某化学兴趣小组同学发现,除二氧化锰外其他物质也能作氯酸钾分解的催化剂,那么氧化铜是否能作氯酸钾分解的催化剂?于是进行了如下的探究。
提出问题:氧化铜是否能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果好?
设计实验:同学们设计了下面三组实验,实验中“待测数据”是生成相同体积的氧气所需时间(其它可能影响实验的因素均忽略)。
实验编号 | 氯酸钾 | 其它物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | 二氧化锰0.5g | |
③ | xg | 氧化铜0.5g |
问题讨论:
(1)实验②中反应的文字表达式是_____,实验③中x的数值为_____。
(2)由实验③与实验_____的“待测数据”相对比,若实验③“待测数据”更_____(填“大”或“小”),则说明氧化铜能加快氯酸钾的分解速率。
反思提升:
(1)若要证明氧化铜是该反应的催化剂,还要设计实验验证它在化学反应前后的_____和_____不变。
(2)你认为同学们设计实验②和实验③的对比的目的是_____。