题目内容
【题目】为测定空气中氧气的含量,小华、小强、小明三位同学分别设计如下方案:
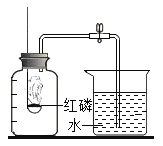
小华:采用如图装置进行实验.(燃烧匙中药品为红磷)请回答下列问题:
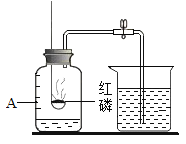
(1)点燃红磷伸入集气瓶,观察到红磷燃烧的现象______________;反应的文字表达式为____________;该实验中红磷需稍过量,目的是________________________________________________。
(2)待燃烧停止,白烟消失并冷却后,打开止水夹,观察到进入集气瓶中水的体积不到总容积的![]() ,你认为其原因可能是
,你认为其原因可能是![]() ______________________、
______________________、![]() ______________________。
______________________。
小强:设计了如下图1所示装置。请根据图示实验回答下列问题:

(3)装置冷却到室温,可观察到U型管内左侧液面________________。
(4)通过这个实验得出的结论是___________________。
(5)此实验可推知反应后剩余气体的两点性质是:①_____________;②____________。
小明:由小华、小强实验得到启发,设计了如下图2的测定实验,但是他看到的现象是水面并没有上升约![]() ,原因是_______________________________。
,原因是_______________________________。
【答案】产生大量白烟,生成一种白色固体 红磷 + 氧气 ![]() 五氧化二磷 将集气瓶中的氧气全部消耗完 红磷量不足(或太少) 未冷却就打开弹簧夹 上升到刻度1 空气中氧气的含量约占空气总体积的1/5 难溶于水 不支持燃烧 蜡烛燃烧有二氧化碳气体生成,瓶内气压基本不变
五氧化二磷 将集气瓶中的氧气全部消耗完 红磷量不足(或太少) 未冷却就打开弹簧夹 上升到刻度1 空气中氧气的含量约占空气总体积的1/5 难溶于水 不支持燃烧 蜡烛燃烧有二氧化碳气体生成,瓶内气压基本不变
【解析】
(1)红磷燃烧产生大量白烟,生成一种白色固体五氧化二磷;反应的文字表式为:红磷+氧气![]() 五氧化二磷;实验中红磷需稍过量的目的是将空气中的氧气排尽;
五氧化二磷;实验中红磷需稍过量的目的是将空气中的氧气排尽;
(2)若红磷的量不足,导致不能将装置内的氧气完全反应掉,测得氧气的体积分数小于五分之一;若装置漏气,导致空气进入集气瓶内,测得的氧气的体积分数小于五分之一;若未等到装置冷却到室温,就打开止水夹,测得的氧气体积分数会小于五分之一;
(3)装置冷却到室温时,可观察到U型管内左侧液面上升,约上升至1处;
(4)通过这个实验得出的结论是氧气约占空气体积的五分之一;
(5)由红磷燃烧一会熄灭了,说明氮气不燃烧不支持燃烧,难溶于水;蜡烛燃烧消耗氧气,但生成物中有二氧化碳气体,故水面没有上升到理论位置,由此可总结出测定空气中氧气含量的反应物所满足的条件是:反应物是固体且只和氧气反应,且反应后不能生成气体。

 计算高手系列答案
计算高手系列答案【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验: Ⅰ.将 3.0g KClO3 与 1.0g MnO2 均匀混合加热
Ⅱ.将 x g KClO3 与 1.0g CuO 均匀混合加热 在相同温度下,比较两组实验产生 O2 的快慢。 Ⅰ中反应的文字表达式是___;
Ⅱ中 x 的值应为___。
②乙探究了影响过氧化氢分解速度的某种因素。实验数据记录如下:
过氧化氢的质量 | 过氧化氢的浓度 | MnO2 的质量 | 相同时间内产生 O2 体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量 O2 体积的装置是___(填编号)。
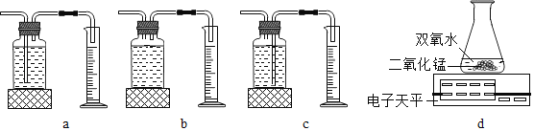
实验结论:在相同条件下,___,过氧化氢分解得越快。 丙用 d 图装置进行实验,通过比较_____也能达到实验目的。
【题目】长期放置于空气中的铜,表面有绿色的物质生成,兴趣小组同学对绿色物质的成分进行下列探究。
(提出问题)绿色物质的成分是什么?
(猜想假设)猜想①:CuO; 猜想②:Cu(OH)2; 猜想③:CuCO3
(讨论交流)同学们做出以上猪想的理论依据是_____;有同学认为猜想①是错误的,其理由是_____。
(查找资料)Cu(OH)2、CuCO3受热易分解,生成物都是氧化物;无水硫酸铜遇水变蓝色。
(实验探究1)
实验 | 实验步骤 | 实验现象 | 实验结论 |
Ⅰ | 取绿色物质于试管中,加入_____,将生成的气体通入澄清石灰水中 | 有气泡产生,生成的气体使澄清石灰水变浑浊 | 猜想_____(填序号)正确 |
Ⅱ | 如下图所示,加热绿色固体 | B中_____ | 猜想②正确 |
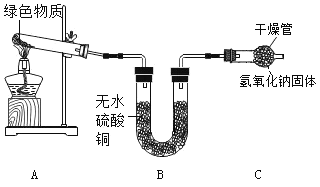
(谈论交流)绿色物质的成分是Cu(OH)2和CuCO3的混合物吗?经询问老师得知绿色物质的成分是 mCu(OH)2 ·nCuCO3.
(实验探究2)取17.3g绿色物质进行反应,经过测定知实验Ⅰ中生成气体的质量为4.4g,实验Ⅱ中装置B的质量曾加0.9 g(假设生成的物质全部被吸收),则m :n=_____ ,
(反思交流)实验Ⅱ中装置C的作用是_____。