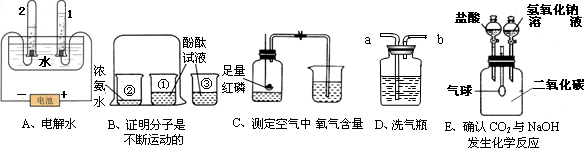
题目内容
(6分)某化学兴趣小组的同学对食品保鲜袋进行了如下研究。
【研究课题】食品保鲜袋的元素组成。
【查阅资料】碱石灰是由NaOH和CaO组成的吸湿剂;无水硫酸铜可作吸水剂,且吸水后由白色变为蓝色。
【提出猜想】保鲜袋可能由“碳、氢、氧”中的两种或三种元素组成。
【实验设计】小组同学设计了如下实验装置,利用燃烧法测定保鲜袋的元素组成。
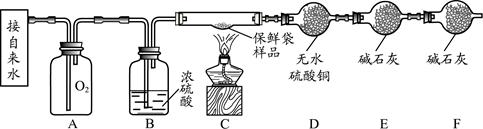
【实验步骤】
(1)按上图图示连接好仪器。
(2)检查装置的气密性。
(3)按图示装好药品和1.4g剪碎的保鲜袋样品,除D、E、F外将仪器按原图组装。
(4)向A中缓慢注水一段时间后,将已称重的D、E两干燥管和未称重的F干燥管接到C的尾端。
(5)点燃C处的酒精灯,直至保鲜袋子碎片完全燃烧。
(6)熄灭酒精灯并继续向A中注水一段时间。
(7)分别对D、E进行第2次称重。
【实验分析】
(1)B处的浓硫酸的作用是 。F处干燥管的作用是 。
(2)在点燃酒精灯前,要向A中缓慢注水一段时间是为了 。
(3)熄灭酒精灯后继续向A中注水一段时间是为了 。
【实验结论】第1次对D、E称重质量分别为(此处缺少数据);第2次对D、E称重质量分别为(此处缺少数据),则该食品保鲜袋的元素组成为 。(本小题无法解答)
【研究课题】食品保鲜袋的元素组成。
【查阅资料】碱石灰是由NaOH和CaO组成的吸湿剂;无水硫酸铜可作吸水剂,且吸水后由白色变为蓝色。
【提出猜想】保鲜袋可能由“碳、氢、氧”中的两种或三种元素组成。
【实验设计】小组同学设计了如下实验装置,利用燃烧法测定保鲜袋的元素组成。

【实验步骤】
(1)按上图图示连接好仪器。
(2)检查装置的气密性。
(3)按图示装好药品和1.4g剪碎的保鲜袋样品,除D、E、F外将仪器按原图组装。
(4)向A中缓慢注水一段时间后,将已称重的D、E两干燥管和未称重的F干燥管接到C的尾端。
(5)点燃C处的酒精灯,直至保鲜袋子碎片完全燃烧。
(6)熄灭酒精灯并继续向A中注水一段时间。
(7)分别对D、E进行第2次称重。
【实验分析】
(1)B处的浓硫酸的作用是 。F处干燥管的作用是 。
(2)在点燃酒精灯前,要向A中缓慢注水一段时间是为了 。
(3)熄灭酒精灯后继续向A中注水一段时间是为了 。
【实验结论】第1次对D、E称重质量分别为(此处缺少数据);第2次对D、E称重质量分别为(此处缺少数据),则该食品保鲜袋的元素组成为 。(本小题无法解答)
【实验分析】
(1)吸收水分。 防止空气中的水分和CO2进入E装置。
(2)排出玻璃管C中的空气;将足量的氧气充入到C装置中,确保样品完全燃烧。
(3)使C中的水蒸气及CO2气体完全被D、E装置吸收。
【实验结论】碳元素和氢元素。(2分)
试题分析:1、【实验分析】
(1)B处的浓硫酸的作用是吸收氧气中的水分。F处干燥管的作用是防止空气中的水分和CO2进入E装置,影响实验结果。
(2)在点燃酒精灯前,要向A中缓慢注水一段时间是为了排出玻璃管C中的空气;将足量的氧气充入到C装置中,确保样品完全燃烧。
(3)熄灭酒精灯后继续向A中注水一段时间是为了将C中的水蒸气和二氧化碳气体全部排出,使C中的水蒸气及CO2气体完全被D、E装置吸收。
点评:本题考查学生设计实验,探究物质组成的能力,了解浓硫酸、无水硫酸铜、碱石灰等的性质与用途是解题的关键。

练习册系列答案
相关题目