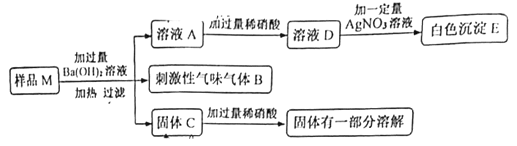
题目内容
【题目】某化学兴趣小组在开展实验活动时,到实验室利用自来水配制氢氧化钠溶液,整个配制过程如下图所示。
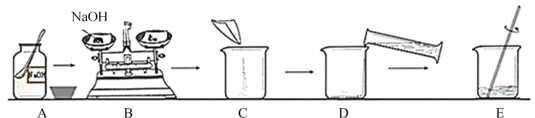
(1)实验操作错误的是_____(填序号),若量取水时俯视读数,则配得的氢氧化钠溶液的溶质质量分数_____(填“偏大”或“偏小”或“不变”)。
(2)几次配制所得的溶液都出现浑浊的现象,放置一段时间后,容器底部还出现白色沉淀物。该兴趣小组的同学针对此奇异的现象展开如下探究:
(实验探究一)用自来水配制氢氧化钠溶液为什么会出现浑浊?
(作出猜想)Ⅰ.氢氧化钠样品不纯,含不溶性杂质;
Ⅱ.氢氧化钠与溶解在自来水中的某物质发生反应生成难溶于水的物质。
(实验探究)小明通过实验很快就排除了猜想Ⅰ,他的实验是_____。
(查阅资料)
①自来水是硬水,常常含有Ca(HCO3)2和Mg(HCO3)2。
②Ca(HCO3)2与足量的氢氧化钠反应方程式:Ca(HCO3)2+2NaOH=CaCO3↓+2H2O+Na2CO3
Mg(HCO3)2与足量的氢氧化钠反应方程式:Mg(HCO3)2+4NaOH=Mg(OH)2↓+2H2O+2Na2CO3
③Mg(OH)2在热水中溶解度增大,可形成稀溶液。
(实验验证)小红取来少量的自来水于烧杯中,往其中加入适量的肥皂水,搅拌,观察到_____的现象,确认所取的自来水是硬水。
(实验探究二)白色浑浊物是什么物质?
(作出猜想)猜想一:白色浑浊物是CaCO3
猜想二:白色浑浊物是Mg(OH)2
猜想三:白色浑浊物是_____。
(实验探究)①取氢氧化钠于烧杯中,加自来水搅拌,杯壁发烫,原因是_____。静置、冷却、过滤。
②取操作①中所得滤渣加稀盐酸,有气泡冒出,说明猜想_____错误。
③另取操作①中所得滤渣_____,液体变红,所以猜想三正确。
(拓展延伸)①实验室在配制溶液时应该使用_____水。
②用上述自来水烧开水常会使暖水瓶附着一层水垢[主要成分是CaCO3和Mg(OH)2],可以用白醋来洗涤。已知白醋中的CH3COOH会解离出![]() 和
和![]() ,请写出CH3COOH与Mg(OH)2发生中和反应的化学方程式_____。
,请写出CH3COOH与Mg(OH)2发生中和反应的化学方程式_____。
【答案】A、B 偏大 取氢氧化钠固体加蒸馏水配制溶液,溶液不浑浊 较多浮渣 CaCO3和Mg(OH)2 氢氧化钠固体溶于水放热 二 加入热的蒸馏水,向上层清液中滴加酚酞溶液 蒸馏水 2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O
【解析】
(1)实验操作A没有将瓶塞倒放,实验操作B中氢氧化钠有强烈的腐蚀性,应放在玻璃器皿中称量;根据仰多俯少,若量取水时俯视读数,水的体积偏少,则配得的氢氧化钠溶液的溶质质量分数偏大。
故填:A、B;偏大。
[实验探究]小明通过实验很快就排除了猜想Ⅰ,他的实验是取氢氧化钠固体加蒸馏水配制溶液,溶液不浑浊。
故填:取氢氧化钠固体加蒸馏水配制溶液,溶液不浑浊。
[实验验证]小红取来少量的自来水于烧杯中,往其中加入适量的肥皂水,搅拌,观察到较多浮渣的现象,确认所取的自来水是硬水。
故填:较多浮渣。
[作出猜想]猜想一:白色浑浊物是CaCO3
猜想二:白色浑浊物是Mg(OH)2
猜想三:白色浑浊物是CaCO3和Mg(OH)2。
故填:CaCO3和Mg(OH)2。
[实验探究]①取氢氧化钠于烧杯中,加自来水搅拌,杯壁发烫,原因是氢氧化钠固体溶于水放热。
故填:氢氧化钠固体溶于水放热。
②碳酸钙与稀盐酸反应生成二氧化碳气体,取操作①中所得滤渣加稀盐酸,有气泡冒出,说明猜想二错误。
故填:二。
③Mg(OH)2在热水中溶解度增大,可形成稀溶液,另取操作①中所得滤渣加入热的蒸馏水,向上层清液中滴加酚酞溶液,液体变红,所以猜想三正确。
故填:加入热的蒸馏水,向上层清液中滴加酚酞溶液。
[拓展延伸]①实验室在配制溶液时应该使用蒸馏水。
故填:蒸馏水。
②CH3COOH与Mg(OH)2发生中和反应的化学方程式2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O。