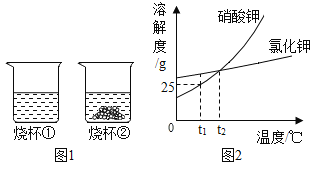
题目内容
【题目】实验室有溶液样品![]() ,其中可能含有
,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种物质中的一种或几种。为确定样品
五种物质中的一种或几种。为确定样品![]() 的成分,设计并完成了如下图所示的实验(假设除标有“过量”外,均恰好完全反应)。
的成分,设计并完成了如下图所示的实验(假设除标有“过量”外,均恰好完全反应)。
(1)气体![]() 为______(填化学式,下同)。
为______(填化学式,下同)。
(2)溶液![]() 中一定含有的阳离子为______。
中一定含有的阳离子为______。
(3)该溶液样品![]() 中一定含有的物质为______。
中一定含有的物质为______。
【答案】![]()
![]() 、
、![]() 、
、![]()
![]() 、
、![]() 、
、![]()
【解析】
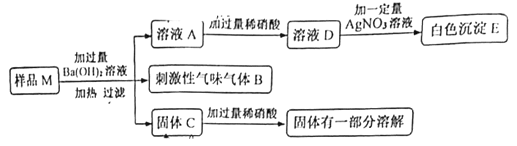
向样品中加过量的氢氧化钡生成刺激性气味的气体B,可知样品中一定有硝酸铵,B是氨气;氢氧化钡与氯化镁反应生成可溶于硝酸的氢氧化镁沉淀,硫酸钠与氢氧化钡反应生成难溶于硝酸的硫酸钡沉淀,固体C中加稀硝酸部分溶解,说明固体C中有硫酸钠和氢氧化镁;溶液D中加硝酸银产生白色沉淀E,说明E是氯化银,溶液D中一定有氯离子。
(1)根据分析知,气体B为NH3。
(2)样品M中有硫酸钠,加入的氢氧化钡和稀硝酸都过量,故溶液D中一定有![]() 、
、![]() 、
、![]() 。
。
(3)该溶液样品![]() 中一定含有的物质为
中一定含有的物质为![]() 、
、![]() 、
、![]() 。
。

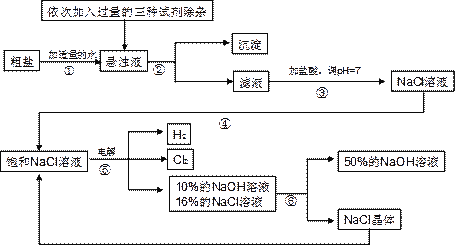
【题目】(7分)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如下:
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,错误的是 。
A.能去除油污,可做厨房清洁剂 | B.易溶于水,溶解时放出大量的热 |
C.水溶液能使石蕊溶液变红 | D.可用作某些气体的干燥剂 |
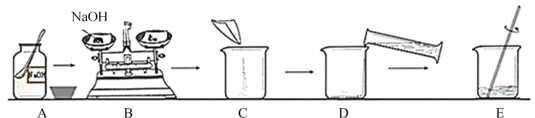
(2)操作②的名称是 ,操作④的名称是 。
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之 (填“前”或“后”)加入。有同学提出用 溶液代替BaCl2溶液可达到同样的目的。
(4)电解饱和NaCl溶液的化学方程式是 。
(5)该流程中可以循环利用的物质是 。
【题目】固体铵盐A、B的成分可能是(NH4)2SO4、NH4HSO4,或是两者的混合物.甲、乙两个研究性学习小组要确定A和B的成分,并测定B中氮元素的质量分数.
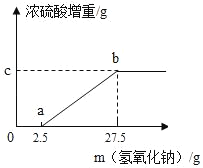
(1)甲实验小组的同学取了数份相同质量的样品A溶于水,然后加入40% NaOH溶液(图中用氢氧化钠质量表示),水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用足量浓硫酸完全吸收,浓硫酸增重的质量如图.分析该图象并回答下列问题:
①写出ab段涉及的化学方程式:_____.
②样品A的成分是_____,C点的数值是_____.
(2)乙实验小组的同学取了数份不同质量的样品B,测定方法与甲组同学大部分相同,不同的是,他们将不同质量的铵盐分别加入到50.00mL NaOH溶液中(含8.12g NaOH),测定结果如下:
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
铵盐的质量(g) | 10.00 | 20.00 | 30.00 | 50.00 |
浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
①分析实验数据可知,实验编号为_____的实验中,氢氧化钠足量,铵盐中的铵根离子完全转化成气体.
②计算B中氮元素的质量分数.______(保留两位小数)
【题目】阅读下面科普短文。
红肉是指猪、牛、羊等哺乳动物的肌肉。因为所含肌红蛋白较多,所以肉质鲜红。红肉中含有蛋白质、脂肪、维生素等,具有很高的营养价值。红肉脂肪中含有的ω﹣3脂肪酸与人体内饱和脂肪酸相互作用,可以降低血栓的形成。研究表明,饮食中适量摄入红肉可以帮助降低血压。
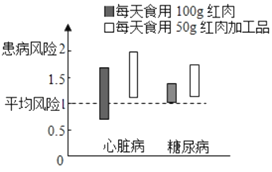
当然,关于红肉的致病风险也有许多研究。有研究者对食用红肉及其加工品与患心脏病和糖尿病风险的关系进行了实验分析。发生相应疾病的风险范围如下图所示。
国际癌症研究机构也对红肉和加工红肉的致癌性进行了评价,认为其致癌可能性较高。还有研究者认为红肉的加工方式会导致致癌风险的增高。加工红肉指经腌制、烟熏或其他工艺处理后的红肉类食品,如香肠,熏制火腿等。在红肉加工过程中,会形成亚硝酸复合物、多环芳烃等致癌物质。其中,由木材不完全燃烧产生多环芳烃类物质苯并芘(C20H12)具有很强的致癌性。红肉加工工艺和苯并芘含量的关系如下表所示。
| 样品名称 | 苯并芘含量 (ug/kg) | 熏制温度 (℃) | 熏制时间 (小时) |
香肠 | 0.5 | 67 | 3 | |
香肠 | 1.1 | 77 | 3 | |
熏制火腿 | 0.5 | 65 | 14 | |
熏制火腿 | 1.3~1.5 | 35 | 500 |
虽然加工红肉中含有一定的致癌物质,但红肉中还有大量的保护因子(如叶酸、维生素A、硒等),因此,因噎废食的做法是不合理的。我们可以通过增加蔬菜水果的摄入量,合理均衡膳食,维持人体健康。
依据文章内容,回答下列问题。
(1)红肉肉质鲜红是因为_____。
(2)红肉中包含的营养素有_____(填字母序号,下同)。A 蛋白质 B 脂肪 C 维生素
(3)推测熏制红肉所用木材中一定含有的元素是_____。
(4)从表中数据推测,影响加工红肉中苯并芘含量的因素可能包括_____。
(5)下列说法正确的是_____。
A 高血压患者一定不能食用红肉
B 加工红肉中的亚硝酸复合物是致癌物质
C 苯并芘分子中碳、氢原子个数比是5:3
D 食用等量的红肉加工品,比食用红肉引发心脏病风险更低。