题目内容
【题目】(17分)实验室常用石灰石和稀盐酸制取二氧化碳。
探究一 气体发生装置的选择
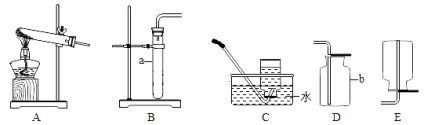
(1)写出图中带标号仪器的名称:a ;b 。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用 和 (填字母),
检验集满的方法是 。
探究二 药品的选择
小明对三组药品进行了研究,实验记录如下:
组别 | 药 品 | 实验现象 |
① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 粉末状石灰石和稀盐酸 | 产生气泡速率很快 |
对照实验①③,是探究 对产生二氧化碳速率的影响;
对照实验 ,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为;
探究三 生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量
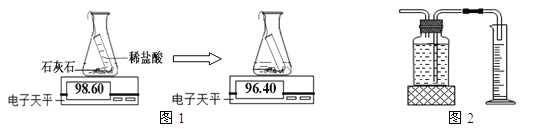
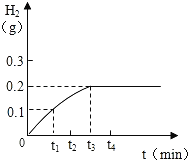
途径一(如图1):由图可知产生二氧化碳的质量为 g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。
由上两种途径比较,你认为哪种途径实验结果更为准确,理由是 。
【答案】探究一、(1)a试管(1分) b集气瓶(1分)
(2)B 和 D (各1分) 燃着的木条放在集气瓶口,若熄灭则满(2分)
探究二、药品的状态(或接触面积)(2分) ①②(2分)
CaCO3+2HCl===CaCl2+H2O+CO2↑(3分)
探究三、2.2g(2分),途径一更准确,途径二中部分二氧化碳溶于水(2分) ;
【解析】
试题分析:探究一:(1)从图中可以看出两种仪器分别是试管和集气瓶;(2)实验室制取二氧化碳是固体和液体在常温下反应,故选择装置B;二氧化碳密度比空气大能溶于水,故应该用向上排空气法收集;验满二氧化碳时将燃烧的木条放在集气瓶口观察木条是否熄灭即可;
探究二:根据实验中①③的反应物的状态不同、实验①②反应中的酸不同分析影响化学反应速率的因素,根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳书写化学方程式;
探究三:根据反应中减少的质量是反应中生成的气体质量得出二氧化碳的质量;根据二氧化碳能溶于水分析更为合理的实验方案。