题目内容
【题目】将Cu﹣Zn合金样品20g放入足量稀硫酸中,所产生氢气的质量与反应时间的关系如图所示.试计算:
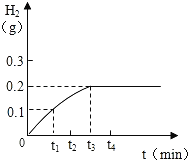
(1)原样品中所含锌的质量.
(2)实验测得20g该样品与154.7g某稀硫酸恰好完全反应,求此时所得溶液中溶质的质量分数.
【答案】(1)6.5g;(2)10%.
【解析】
试题分析:解:因为铜与稀硫酸不能反应,不能生成氢气,根据题意和图示,0.2g氢气是锌与稀硫酸完全反应生成氢气的质量;
设原样品中锌的质量为x,生成ZnSO4的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
(1)![]() x=6.5g
x=6.5g
(2)![]() y=16.1g
y=16.1g
反应后溶液的质量为:154.7g+6.5g﹣0.2g=161g,
所得溶液中溶质的质量分数为: ![]() ×100%=10%
×100%=10%
答:(1)原样品中所含锌的质量为6.5g;(2)样品与稀硫酸完全反应后,所得溶液中 溶质的质量分数为10%.

【题目】(17分)实验室常用石灰石和稀盐酸制取二氧化碳。
探究一 气体发生装置的选择
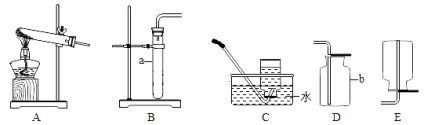
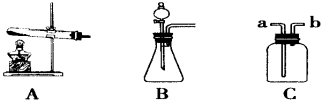
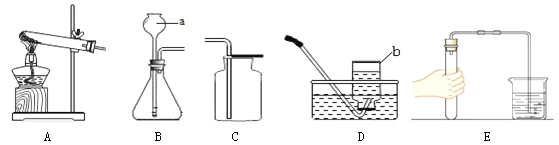
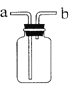
(1)写出图中带标号仪器的名称:a ;b 。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用 和 (填字母),
检验集满的方法是 。
探究二 药品的选择
小明对三组药品进行了研究,实验记录如下:
组别 | 药 品 | 实验现象 |
① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 粉末状石灰石和稀盐酸 | 产生气泡速率很快 |
对照实验①③,是探究 对产生二氧化碳速率的影响;
对照实验 ,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为;
探究三 生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量
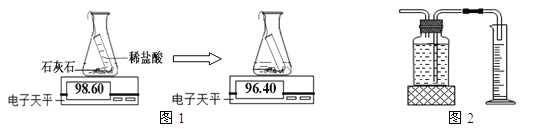
途径一(如图1):由图可知产生二氧化碳的质量为 g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。
由上两种途径比较,你认为哪种途径实验结果更为准确,理由是 。